
 2C(g)(正向放热)下列叙述正确的是( )
2C(g)(正向放热)下列叙述正确的是( ) 口算能手系列答案
口算能手系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3C(g) +
3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线
nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线 上的任何一点都表示平衡状态)。下列有关该反应的描述错误的是 ( )
上的任何一点都表示平衡状态)。下列有关该反应的描述错误的是 ( )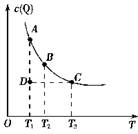
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:( )
2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:( )| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 〔CuCl4〕2ˉ(绿色)+4H2O 下列操作可以使溶液变蓝色的是:
〔CuCl4〕2ˉ(绿色)+4H2O 下列操作可以使溶液变蓝色的是:| A.向溶液中加入少量NaCl晶体 | B.向溶液中滴加少量浓盐酸 |
| C.向溶液中滴加少量AgNO3溶液 | D.加水将溶液稀释 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 和
和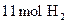 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应

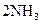 ,当在某
,当在某 一温度下达到化学平衡状态,试解答:
一温度下达到化学平衡状态,试解答: 的转化率.
的转化率. 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com