
 某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )| A. | 反应2min末X的浓度为0.35mol/L | |
| B. | 该反应的化学方程式可表示为:2Z?2Y+3X | |
| C. | 反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(L•min) | |
| D. | 任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y) |
分析 由图象可知2min时,△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.2-0)mol=0.2mol,同一反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.2mol:0.2mol=3:2:2,则方程式为3X+2Y?2Z,以此解答该题.
解答 解:A.反应2min末X的物质的量为0.7mol,则浓度为$\frac{0.7mol}{2L}$=0.35mol/L,故A正确;
B.由图象可知X、Y的物质的量减少,为反应物,Z的物质的量增大,为生成物,方程式为3X+2Y?2Z,故B错误;
C.反应2min内以Z浓度变化表示的平均反应速率为$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),故C正确;
D.Y、Z的计量数相等,则任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y),故D正确.
故选B.
点评 本题考查图象分析,为高频考点,侧重考查学生分析及计算能力,明确曲线变化趋势含义、物质的量变化量与其计量数的关系即可解答,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A. | 该反应的还原剂是Cl- | |
| B. | 反应后溶液的酸性明显增强 | |
| C. | 消耗1mol还原剂,转移6 mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
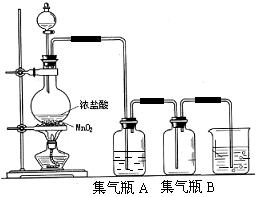 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.| 乙醇 | 四氯化碳 | 碘(晶体) | |
| 密度/g•cm-3 | 0.7893 | 1.595 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 184.35 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
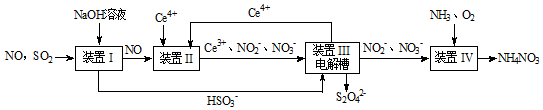
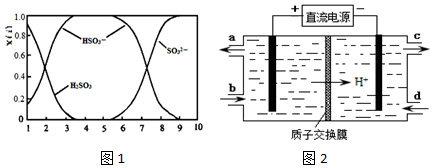
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 易溶于水 | |
| B. | 一氯代物有5种 | |
| C. | 最多能与氢气以物质的量之比1:4加成 | |
| D. | 碱性水解的产物之一是1-丙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com