
| A. | 通入N2 | B. | 加压 | ||
| C. | 升高温度 | D. | 使用合适的催化剂 |
分析 A、通入一种物质,另一种物质的转化率升高,而本身的转化率降低;
B、两边气体计量数相等,所以加压平衡不移动;
C、升高温度平衡向吸热反应方向移动;
D、使用合适的催化剂,平衡不移动;
解答 解:A、通入一种物质,另一种物质的转化率升高,而本身的转化率降低,所以通入氮气,氧气的转化率升高,而氮气本身转化率降低,故A错误;
B、两边气体计量数相等,所以加压平衡不移动,氮气的转化率不变,故B错误;
C、升高温度平衡向吸热反应方向移动,所以平衡正向移动,则氮气转化率变大,故C正确;
D、使用合适的催化剂,平衡不移动,则氮气的转化率不变,故D错误;
故选C.
点评 本题考查化学平衡移动影响因素,比较基础,注意理解化学平衡移动原理.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
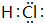 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
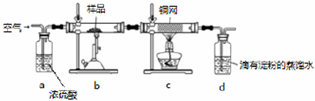
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数是NA | |
| B. | 常温常压下,NA个CO2占有的体积为22.4L | |
| C. | 1.06克Na2CO3含有Na+数为0.02NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
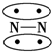 ,CO的结构可以表示为
,CO的结构可以表示为 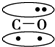 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有三键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
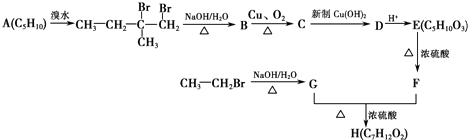
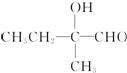 +2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$
+2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$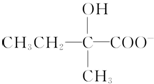 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.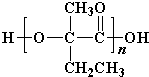 .
.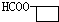 、
、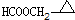 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com