
如图所示,把1体积CH4和4体积Cl2组成的混合气体充入量筒中,将此量筒倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是:
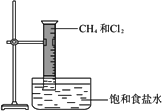
(1)________;(2)________;
(3)________;(4)________.
|
答案:(1)量筒内黄绿色逐渐消失,并产生白雾 (2)量筒壁上有黄色油珠 (3)水位在量筒内上升 (4)水槽内有少量晶体析出 解析:CH4和Cl2光照生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl等物质,随着Cl2不断消耗,黄绿色逐渐消失,又由于CH2Cl2、CHCl3、CCl4常温下为无色液体,Cl2易溶于有机溶剂,量筒壁上有黄色油珠.因生成的HCl易溶于水,反应后量筒内气体压强减小,水位沿量筒壁上升.HCl溶于水后,饱和食盐水中Cl-浓度增大,使结晶速率>溶解速率.故水槽内有少量晶体析出.物质的物理性质(色、态、味、水溶性等)以及化学性质是回答实验现象的依据.该题考查甲烷与氯气在光照条件下发生的取代反应和几种氯代甲烷以及氯化氢的性质等知识.甲烷和氯气的取代反应是分4步进行的连锁反应.饱和食盐水中溶解氯化氢会有食盐晶体析出是学生知识上的盲点. |


科目:高中化学 来源: 题型:
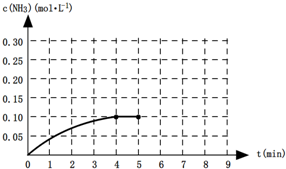
 一定温度下,向一2L的恒容密闭容器内加入0.2molN2和0.6mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:
一定温度下,向一2L的恒容密闭容器内加入0.2molN2和0.6mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:


|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
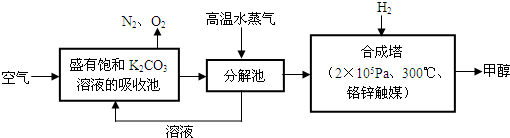
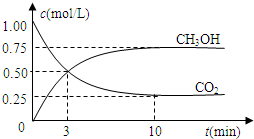
查看答案和解析>>
科目:高中化学 来源: 题型:
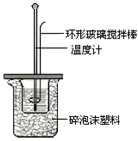 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.3 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.0 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com