
一未配平的离子方程式为______+XO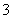 +6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
+6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
A.1∶1 B.3∶1 C.5∶1 D.7∶1
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
已知X、Y是原子核电荷数不大于18的元素。若X、Y两元素化合物组成是YX3,已知X原子的最外层电子数为a+2,次外层电子数为a+3;Y原子的最外层电子数为b-3,次外层电子数为b。则a和b的值分别是( )
A、3,2 B、2,3 C、5,6 D、5,8
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组设计实验探究铜与浓硫酸的反应。
某研究性学习小组设计实验探究铜与浓硫酸的反应。
(1) 如果用图1装置进行实验:
① 装置A中反应的化学方程式_____________________________________________ 。
② 实验结束后,欲验证反应生成气体的还原性,小组同学取装置B中溶液少量于一洁净的试管中,应向试管中加入的试剂是________(填序号)。
A.品红溶液 B.稀盐酸 C.BaCl2溶液 D.稀硝酸
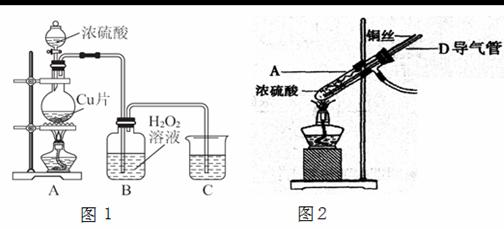
(2)为了更符合绿色化学的要求,该小组有同学建议用图2装置替换图1装置中的A部分进行探究实验。针对图2装置回答:
①改进后的装置符合绿色化学思想的设计是 。
②准备结束实验时立即熄灭酒精灯,B中的液体不会倒吸,其原因是 。
③拆除装置前,不打开胶塞,要使装置中残留气体完全被吸收,应当采取的操作是
。
(3)实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:a ) 氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
b ) 硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验:
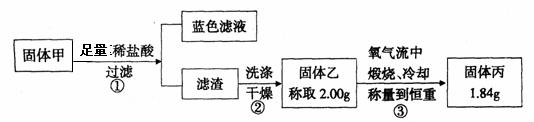
①在煅烧过程中一定发生的反应的化学方程式为 。
②下列对于固体甲成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在 B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S D.固体甲中可能有Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
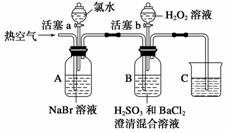
实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,滴加 氯水,关闭活塞a | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是__ _____________________________________________。
_____________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是__________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是__________________
______________________________________________________。
(5)由上述实验得出的结论是________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
(2013·新课标全国卷Ⅱ,27)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
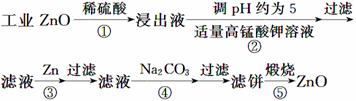
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2)∶n(NO)=1∶1时,下列说法正确的是 ( )
A.产物n[Cu(NO3)2]∶n[CuSO4]=1∶1
B.参加反应的n(Cu2S)∶n(HNO3)=1∶5
C.反应中Cu2S既作氧化剂,又作还原剂
D.1 mol Cu2S参加反应时转移8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO3(s) + CO(g) MgO(s) + CO2(g) +SO2(g) △H>0
MgO(s) + CO2(g) +SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.同周期金属元素的化合价越高,其原子失电子能力越强
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,则该元素对应的气态氢化物稳定性越强
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com