
下列表示对应化学反应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O===[Al(OH )4]-+4NH
)4]-+4NH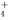
B. 铅酸蓄电池充电时的正极反应:PbO2+4H++SO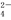 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
C.Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-===Fe(OH)3 ↓ + BaSO4↓
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-===Fe(OH)2↓+2NH3·H2O
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
食盐是一种常用的食品添加剂。新鲜鱼、肉用食盐腌渍后可以延长保存期,是因为( )
A.NACl中的Cl-有杀菌作用 B.浓食盐水中含O2少,细菌无法生存
C.由于渗透作用使细菌失水死亡 D.由于渗透作用使鱼、肉细胞失水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中文化学卷(解析版) 题型:选择题
人们必需从食物中摄入维持正常生命活动所需要的各种元素,如果某种元素摄入不足或过多,就会影响人体健康甚至导致疾病。下列有关说法错误的是( )
A.成人缺碘会引起甲状腺肿大
C.缺铁会产生缺铁性贫血
B.儿童缺碘会导致发育迟缓
D.缺锌会影响骨骼、牙齿的生长
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上第二阶段考化学试卷(解析版) 题型:推断题
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
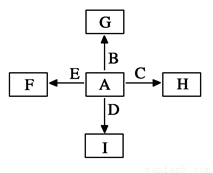
已知:①G为红棕色固体,能发生反应C+G B+H,该反应会放出
B+H,该反应会放出
大量的热②I是一种常见的温室气体,它和E可以发生反应:
2E+I 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题:
(1)①中反应的化学方程式为_____________________;
(2)化合物I的电子式为___________,它的空间构型是________________;
(3)8.0g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量____________g;
(4)C与过量NaOH溶液反应后溶液与过量化合物I反应的离子方程式为_____________;
(5)E在I中燃烧观察到的现象是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上第二阶段考化学试卷(解析版) 题型:选择题
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图所示(反应条件和部分产物略去)。下列说法中不正确的是
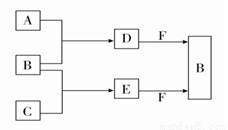
A.F中阴阳离子个数比为1:1
B.化合物F中既有离子键又有共价键
C.合成过程中的反应 均是氧化还原反应
均是氧化还原反应
D.1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:实验题
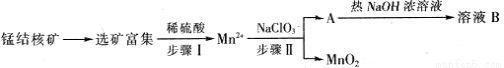
MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示:
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4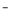 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0. 5molMn2+时,用去1mol•L-1的NaClO3溶液200ml,该反应离子方程式为
(2)已知溶液B的溶质之一可 循环用于上述生产,此物质的名称是_____________。
循环用于上述生产,此物质的名称是_____________。
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 。如果维持电流强度为5A,电池工作五分钟,理论消耗锌 g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2 )中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 。
)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 。
。向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2 。
(5)用废电池的锌皮制作ZnSO4•7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为 时,铁刚好沉淀完全(离子浓度小于1×10﹣5mol•L﹣1时,即可认为该离子沉淀完全)。继续加碱调节pH为 时,锌开始沉淀(假定Zn2+浓度为0.1mol•L﹣1)。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中不正确的是
A.20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0mol·L-1
B.20℃时,将29.8gKCl溶于87.6g水中可得饱和溶液
C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
在防止禽流感疫情时,防疫部门使用了大量含氯类消毒剂,其中的一氯胺(NH2Cl)是一种长效缓释有机氯消毒剂,能水解生成具有强氧化性的物质,其杀菌能力是一般含氯消毒剂的4~5倍。下列有关一氯胺的说法正确的是( )
A.一氯胺中氯元素的化合价为-1价
B.一氯胺水解 的产物为NH2OH(羟氨)和HCl
的产物为NH2OH(羟氨)和HCl
C.一氯胺起消毒作用的物质与漂白粉起消毒作用的物质相同
D.一氯胺的摩尔质量为51.5
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示。下列有关的说法错误的是( )
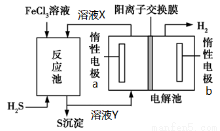
A. 惰性电极a发生氧化反应
B. Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解
C. 溶液Y加热蒸发灼烧最终得到Fe2O3
D. 电解池总反应的离子方程式为2Fe2++2H+ 2Fe3++H2↑
2Fe3++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com