
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示。
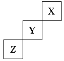
(1)X元素的单质分子式是___。若X核内中子数与质子数相等,X单质的摩尔质量是___。
(2)Y单质的电子式是___。
Y单质与水反应的化学方程式:___。
Z与钠形成的化合物的电子式是:___。
【答案】He 4g/mol ![]() 2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2 ![]()
【解析】
根据短周期元素在周期表中的位置可知X为He元素,Y为F元素,Z为S元素,据此解答。
根据短周期元素在周期表中的位置可知X为He元素,Y为F元素,Z为S元素。
(1)X元素为He,属于惰性气体元素,单质分子式为He,若He核内中子数与质子数相等,质量数为2+2=4,则He单质的摩尔质量是4g/mol;
(2)Y元素为F,单质化学式为F2,电子式为:![]() ,F2是氧化性最强的非金属单质,能与水发生反应,化学方程式为:2F2+2H2O=4HF+O2;Z为S元素,与钠形成的化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,其电子式为:
,F2是氧化性最强的非金属单质,能与水发生反应,化学方程式为:2F2+2H2O=4HF+O2;Z为S元素,与钠形成的化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,其电子式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】电化学知识在物质制备领域的应用前景看好。

(1)从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
①电解过程中阳极的电极反应式为______________________;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的___________(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗C1O-的物质的量为______mol;
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为_________;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为_____________g。
(3)用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 | 消耗NaOH溶液的体积/mL | 待测稀盐酸的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
根据表格计算c(HCl)=______________。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将__________ (填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A _______ ,B________,C________,D________,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
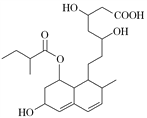
①能与FeCl3溶液发生显色反应 ②能使酸性KMnO4溶液褪色 ③能发生加成、取代、消去反应 ④1 mol 该物质最多可与1 mol NaOH 反应
A. ①②B. ②③C. ①④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既不能使溴水褪色,又不能使酸性高锰酸钾溶液褪色的是
①乙烷 ②乙烯 ③乙炔 ④苯 ⑤甲苯 ⑥溴乙烷 ⑦聚丙烯 ⑧环己烯
A. ①②③⑤ B. ①④⑥ C. ①④⑥⑦ D. ②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B. 常温下,浓度均为0.1 mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C. 将相同体积的pH=3的硫酸和pH=11的NaOH溶液混合,所得溶液一定为中性
D. 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)泡沫灭火器的灭火原理是(用离子方程式表示)_____________________。
(2)①已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
②某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- ![]() H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
(3)pH=2的两种一元酸HA和HB,体积均为100 mL,稀释过程中pH与溶液体积的关系如图。
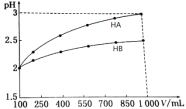
①则NaB水溶液是否呈中性?原因?______________(用离子方程式表示)。
②用NaOH溶液滴定HB溶液,指示剂宜选择_________,滴定终点现象为____________。
A.甲基橙 B.酚酞 C.石蕊
(4)NaHSO3溶液呈酸性,则溶液中,各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
C. 向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. 碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO![]() =BaCO3↓+CO
=BaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com