
【题目】锰的化合物种类较多,也大多具有广泛的用途。
I. MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:

①从以上实验中,我们可以得出的结论是_________________________________。
②写出C试管中发生反应的离子方程式:_________________________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:

已知Fe3+、Mn2+沉淀的pH为上表所示。
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_____________________。
②步骤二中需控制pH的范围是 ___________ 。
③步骤三中是否洗涤干净的判断方法是 _______________ 。
【答案】Ⅰ.(1)D;(2)①酸性越强,MnO2的氧化能力越强;②MnO2+4H++2I-=Mn2++I2+2H2O;
Ⅱ. ①2∶1;②pH≥10.4;③最后的洗涤液呈中性。
【解析】
试题分析:I.(1)A、MnO2只跟浓盐酸反应且需要加热,故错误;B、MnO2作催化剂,不是氧化剂,故错误;C、BaSO3也是白色沉淀,故错误;D、如果溶液变为血红色,说明MnO2的氧化性,故正确;(2)①根据表格中的数据,在酸性条件下溶液迅速变为棕褐色,说明I-迅速被氧化成I2,因此得出结论是:酸性越强,MnO2的氧化能力越强;②I-→I2化合价升高1价,MnO2中Mn由+4价→+2价降低2价,最小公倍数为2,则I-系数为2,MnO2的系数为1,然后根据电荷守恒和元素守恒,配平其他,因此离子反应方程式为:MnO2+4H++2I-=Mn2++I2+2H2O;II.①根据铁酸锰的化学式MnFe2O4,以及元素守恒,推出两者物质的量之比为2:1;②根据工艺流程,需要保证Fe3+、Mn2+全部转化成沉淀,因此调节pH≥10.4;③沉淀表面是KOH,因此检验沉淀是否洗净,检验溶液是否是中性,因此是:最后的洗涤液呈中性。


科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
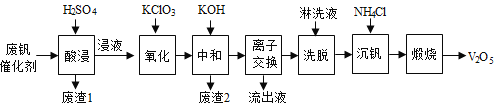
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为________________________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为_____________mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有______________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
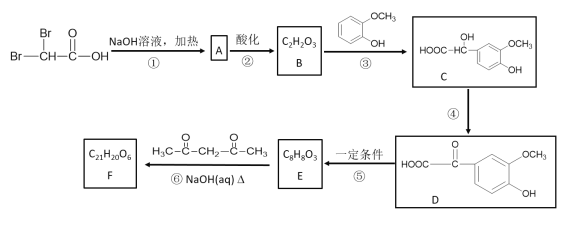
【题目】有机物F(C21H20O6)在临床医学上具有预防肿瘤的作用,其合成路线如下:其中反应③中反应物的原子利用率为100%。
已知:
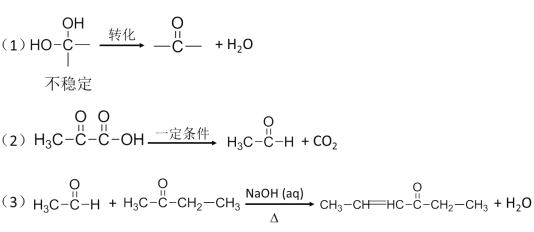
请回答下列问题:
(1)B中含有的官能团名称是___________。③的反应类型为__________。
(2)反应①的化学方程式是________________。反应④的化学方程式是___________。
(3)E的结构简式是______________。F的结构简式是__________________。
(4)E的同分异构体中,同时符合下列两个条件的共有种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为______________。
①苯环上的一取代物只有2种;
②1 mol该物质与足量NaOH溶液反应时,反应消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)糖类、油脂和蛋白质都是生命中重要的有机物质。
(1)淀粉在硫酸作用下发生水解反应,检验淀粉水解后生成葡萄糖所需的试剂为 。
(2)最近,在韩国出现中东呼吸综合征疫情,防疫人员用84消毒液对地铁进行消毒,这是利用了蛋白质的性质: (填序号):A.两性,B.水解,C.变性,D.盐析。
(3)某油脂A的结构简式为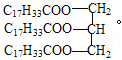 。从酯的性质看,油脂A在酸性条件下和碱性条
。从酯的性质看,油脂A在酸性条件下和碱性条
件下均能发生水解,水解的共同产物是 (写结构简式)。
(4)聚丙烯酸钠、涤纶的结构简式如下:
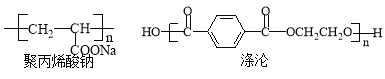
合成聚丙烯酸钠的单体的结构简式是 ,反应类型是 ;
合成涤纶有两种单体,其中能和NaHCO3反应的单体的结构简式是 ,其核磁共振氢谱的峰面积比是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2C(g)+D(g)在四种不同条件下的反应速率分别为( )。
2C(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min)
②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min)
④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A. ① B. ② C. ③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-═Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种重要的基本化工原料,能使溴的四氯化碳溶液褪色,其产量常用于衡量一个国家石油化工发展水平的标志,也是一种植物生长调节剂。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)B的官能团的名称是 ,G是一种高分子化合物,其链节是 。
(2)由A生成F的反应类型是 反应,B生成C的化学方程式是 。
(3)B和D反应生成E的化学方程式是 ,该反应类型是反应 。
(4)工业上用30吨D与46吨B反应,如果实际产率是理论产率的67%,则实际可得到的E的质量是 (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下AgCl在NaI溶液中开始转化为AgI则NaI的浓度必须不低于![]() ×10-11 mol·L-1
×10-11 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为:
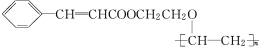
按下图流程可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
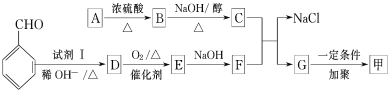
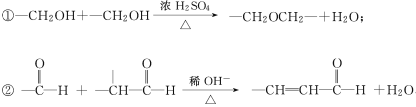
已知:
回答下列问题:
(1)质谱图显示A的相对分子质量是80.5。A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素。A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2∶2∶1。A的结构简式为 。
(2)试剂Ⅰ的名称是________________;B→C的反应类型是________________。
(3)写出下列反应的化学方程式:
①A→B:________________________;
②D→E:________________________;
③C与F的反应:________________________。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com