
| A. | X与Y能形成两种化合物,但化学键类型不相同 | |
| B. | Y与氢形成化合物YH,分子内存在离子键 | |
| C. | X与氢可形成化合物H2X2,分子内部存在极性键和非极性键 | |
| D. | Y2X2中阴、阳离子个数比1:2 |
分析 X元素的L层比Y元素的L层多2个电子,说明X的L层电子数小于8,X应为第二周期元素,Y元素原子的核外电子总数比X元素原子的核外电子总数多3个,说明Y应含有M层电子,故X的最外层电子数为8-2=6,故X为O元素,Y原子核外电子数总数为8+3=11,故Y为Na元素,以此解答该题.
解答 解:X元素的L层比Y元素的L层多2个电子,说明X的L层电子数小于8,X应为第二周期元素,Y元素原子的核外电子总数比X元素原子的核外电子总数多3个,说明Y应含有M层电子,故X的最外层电子数为8-2=6,故X为O元素,Y原子核外电子数总数为8+3=11,故Y为Na元素.
A.O和Na可形成Na2O或Na2O2,前者含有离子键,后者含有离子键、共价键,故A正确;
B.Y与氢形成化合物NaH,属于离子晶体,不是分子晶体,故B错误;
C.X与氢可形成化合物H2O2,分子内部存在极性键和非极性键,故C正确;
D.Na2O2中阴、阳离子个数比1:2,故D正确,
故选B.
点评 本题考查原子结构与元素性质,侧重于学生的分析能力和推断能力的考查,注意把握元素结构的特点和规律,B选项为易错点,学生容易只考虑离子键,忽略题目中描述的“分子”,题目难度不大.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
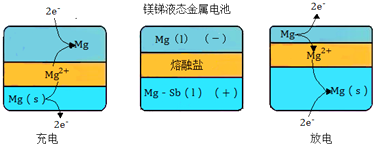
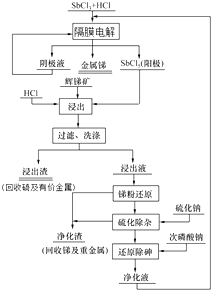
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
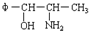 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原产物 | B. | 还原剂和氧化产物 | ||
| C. | 氧化剂和催化剂 | D. | 还原剂和催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
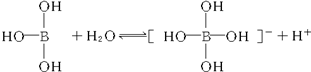
| A. | 凡是酸或碱对水的电离都是抑制的 | |
| B. | 硼酸分子中除氢原子外每个其他原子最外层都满足8电子稳定结构 | |
| C. | 硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素Z的最高价氧化物的水化物显两性 | |
| B. | XY3中的X呈+3价 | |
| C. | Y最高价氧化物水化物的酸性比W的强 | |
| D. | Z与Q形成的是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(M)=0.4 mol/(L•min) | B. | v(N)=0.4 mol/(L•min) | ||
| C. | v(M)=0.8 mol/(L•min) | D. | v(E)=0.45 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
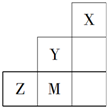
| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素种类 | B. | 核电荷数 | C. | 电子层数 | D. | 中子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com