
”¾ĢāÄæ”æ½ØÖž¹¤µŲ³£ÓƵÄNaNO2ŅņĶā¹ŪŗĶŹ³ŃĪĻąĖĘ£¬ÓÖÓŠĻĢĪ¶£¬ČŻŅ׏¹ČĖĪóŹ³ÖŠ¶¾”£¼ŗÖŖNaNO2ŗĶHIÄÜ·¢ÉśČēĻĀ·“Ó¦£ŗ______NaNO2 +_______HI ”ś_________NO”ü+_____ I2 + _________NaI +_____
£Ø1£©Ēė½«Éś³ÉĪļ²¹³äĶźÕū²¢ÅäĘ½£¬²¢ÓƵ„ĻßĒŷرź³öµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄ攣___________
£Ø2£©ÉĻŹö·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ_________£¬Čō±ź×¼×“æöĻĀÉś³É3.36L NO£¬Ōņ·“Ó¦ÖŠ×ŖŅʵē×ӵďżÄæŹĒ______________”£
£Ø3£©øł¾ŻÉĻŹö·“Ó¦£¬æÉÓĆŹŌÖ½ŗĶÉś»īÖŠ³£¼ūµÄĪļÖŹ½ųŠŠŹµŃ飬ŅŌ¼ų±šNaNO2ŗĶNaCl£¬æÉŃ”ÓƵÄĪļÖŹÓŠ£ŗ¢ŁĖ® ¢Śµķ·Ūµā»Æ¼ŲŹŌÖ½ ¢Ūµķ·Ū ¢Ü°×¾Ę¢ŻŹ³“×£¬½ųŠŠŹµŃéŃ”ÓĆĪļÖŹŗĻŹŹµÄŹĒ______£ØĢī×ÖÄø±ąŗÅ£©”£
A£®¢Ł¢Ū ¢Ż B£®¢Ł¢Ś ¢Ü C£®¢Ł¢Ś¢Ż D£®¢Ś¢Ü¢Ż
£Ø4£©Ä³¹¤³§·ĻŅŗÖŠ£¬ŗ¬ÓŠ2%”Ŗ5%µÄNaNO2£¬Ö±½ÓÅÅ·Å»įŌģ³ÉĪŪČ¾£¬²ÉÓĆNH4ClÄÜŹ¹NaNO2×Ŗ»ÆĪŖ²»ŅżĘš¶ž“ĪĪŪČ¾µÄN2£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_______________”£
£Ø5£©°ŃĀČĘųĶص½NaNO2ČÜŅŗÖŠ£¬Éś³ÉNaNO3ŗĶHCl£¬Š“³ö·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ______”£
£Ø6£©ŃĒĻõĖįŃĪæɽ«Õż³£µÄŠÆŃõŃĒĢśŃŖŗģµ°°××Ŗ»Æ³ÉČż¼ŪĢśŃŖŗģµ°°×£¬Ź§Č„ŠÆŃõÄÜĮ¦£¬ŅżĘš×éÖÆȱŃõµ¼ÖĀÖŠ¶¾”£ĆĄĄ¶ŹĒŃĒĻõĖįŃĪÖŠ¶¾µÄÓŠŠ§½ā¶¾¼Į”£ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ_______”£
A£®ŌŚÖŠ¶¾¹ż³ĢÖŠŠÆŃõŃĒĢśŃŖŗģµ°°×±»Ńõ»Æ B£®ÖŠ¶¾Ź±ŃĒĻõĖįŃĪ·¢ÉśŃõ»Æ·“Ó¦
C£®Ņ©Ę·ĆĄĄ¶Ó¦¾ßÓŠ»¹ŌŠŌ D£®½ā¶¾Ź±Čż¼ŪĢśŃŖŗģµ°°×±»»¹Ō
”¾“š°ø”æ2 4 2 1 2 2 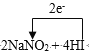 = 2NO”ü + I2 + 2NaI + 2H2O 1:1 0.15N A C NaNO2 + NH4Cl = NaCl + N2”ü+ 2 H2O NO2-+ Cl2+ H2O = NO3-+ 2Cl-+2H+ B
= 2NOӟ + I2 + 2NaI + 2H2O 1:1 0.15N A C NaNO2 + NH4Cl = NaCl + N2ӟ+ 2 H2O NO2-+ Cl2+ H2O = NO3-+ 2Cl-+2H+ B
”¾½āĪö”æ
(1) ”¢Ńõ»Æ»¹Ō·“Ó¦ÖŠ£¬»ÆŗĻ¼ŪÉżøßÖµ=»ÆŗĻ¼Ū½µµĶÖµ=×ŖŅʵē×ÓŹż£¬ĄūÓƵē×ÓŹŲŗ楓ÅäĘ½·½³ĢŹ½£»µ„ĻßĒÅÓÉŹ§µē×ÓµÄĪļÖŹÖøĻņµĆµē×ÓĪļÖŹ£¬²¢±źĆ÷×ŖŅʵĵē×ÓŹż£»
(2)”¢øł¾Ż»ÆŗĻ¼ŪÉż½µÅŠ¶ĻŃõ»Æ¼Į£¬»ÆŗĻ¼Ū½µµĶŌŖĖŲĖłŌŚµÄ·“Ó¦ĪļŹĒŃõ»Æ¼Į£¬øł¾Ż»Æѧ·½³ĢŹ½½įŗĻµē×Ó×ŖŅĘĒéæöĄ“¼ĘĖć£»
(3) ”¢øł¾Ż·“Ó¦Ź±ÓŠ³Įµķ”¢ĘųĢ唢ŃÕÉ«±ä»ÆµČĆ÷ĻŌĻÖĻóŃ”ŌńŹŌ¼Į£»
(4)(5)”¢øł¾ŻŃõ»Æ»¹Ō·“Ó¦µÄ¹ęĀɏ銓£»
(6)”¢ŃĒĻõĖįÄĘ½ųČėČĖĢåŗó£¬æɽ«ŃŖŅŗÖŠµÄµĶĢśŃŖŗģµ°°×Ńõ»Æ³ÉøßĢśŃŖŗģµ°°×£¬ŌņŃĒĻõĖįŃĪ¾ßÓŠŃõ»ÆŠŌ£¬FeŌŖĖŲµÄ»ÆŗĻ¼ŪÉżøߣ¬Ź¹ČĖĢåÖŠ¶¾£»ĆĄĄ¶ŹĒŃĒĻõĖįŃĪÖŠ¶¾µÄÓŠŠ§½ā¶¾¼Į£¬ŌņĆĄĄ¶¾ßÓŠ»¹ŌŠŌ£¬ÓėĢśĄė×Ó·“Ó¦£¬æɽā¶¾£¬ŅŌ“ĖĄ“½ā“š”£
(1)”¢ŌŚ·“Ó¦ÖŠ£¬NŌŖĖŲµÄ»ÆŗĻ¼Ū“Ó+3¼Ū½µµĶµ½ĮĖ+2¼Ū£¬µĆµ½ĮĖ1molµē×Ó£¬IŌŖĖŲµÄ»ÆŗĻ¼Ū“Ó- 1¼ŪÉżøßµ½ĮĖ0¼Ū£¬¹²Ź§Č„µē×Ó2mol£¬øł¾Żµē×ÓŹŲŗć£¬Ėłŗ¬µŖŌŖĖŲµÄĪļÖŹĒ°±ß¶¼³ĖŅŌĻµŹż2£¬µāµ„ÖŹĻµŹżŹĒ1£¬øł
¾ŻŌ×ÓŹŲŗć£¬NaI Ē°±ßµÄĻµŹżĪŖ2£¬HI Ē°±ßµÄĻµŹżŹĒ4£¬Ė®µÄĒ°±ßŹĒĻµŹż2£¬¹Ź“š°øĪŖ2; 4; 2;1; 2; 2.£» = 2NO”ü + I2 + 2NaI + 2H2O£»
= 2NO”ü + I2 + 2NaI + 2H2O£»
(2)”¢2NaNO2 + 4HI=2NO+ I2+ 2NaI+ 2H2O£¬µŖŌŖĖŲµÄ»ÆŗĻ¼Ū½µµĶ£¬ĖłŅŌ2molNaNO2ŹĒŃõ»Æ¼Į£¬4molHI²Ī
Óė·“Ó¦£¬µ«2molHIĪŖ»¹Ō¼Į£¬øĆ·“Ó¦×ŖŅʵē×ÓŹĒ2mol”£3.36L NOµĆĪļÖŹµÄĪŖ0.15mol£¬ĖłŅŌČōÓŠ0.15molNOÉś³É£¬Ōņ·“Ó¦ÖŠ×ŖŅʵē×ӵďżÄæŹĒ0.15moL£¬¼“0.15N A£»
¹Ź“š°øĪŖ£ŗ1:1£¬0.15N A£»
(3)¢ŁĖ®”¢¢Ūµķ·Ū”¢¢Ü°×¾ĘÓėNaNO2¶¼²»·“Ó¦£¬ĖłŅŌĪŽĆ÷ĻŌĻÖĻó£»KIÓėNaNO2·“Ӧɜ³ÉI2±ŲŠėŌŚĖįŠŌĢõ¼žĻĀ²ÅÄÜ·“Ó¦£¬Ź³“×»įµēĄė³öĪ¢ĮæµÄĒāĄė×Ó£¬µā»Æ¼ŲŌŚŹ³“×±¾Éķ“ųµÄČܼĮĖ®ÖŠµēĄė³öµāĄė×Ó£¬ŃĒĻõĖįÄʵēĄė³öŃĒĻõĖįøłÓėÄĘĄė×Ó£¬·¢Éś·“Ӧɜ³Éµāµ„ÖŹ£¬I2Ź¹ŹŖČóµÄµķ·Ūµā»Æ¼ŲŹŌÖ½±äĄ¶£¬¹Ź¢Ł¢Ś¢ŻÕżČ·£»
¹Ź“š°øĪŖ£ŗC£»
(4)”¢ŃĒĻõĖįÄĘÖŠµŖµĆµ½3øöµē×ÓÖøĻņµŖĘųÖŠµÄµŖ£¬ĀČ»Æļ§ÖŠµŖŹ§Č„3µē×ÓÖøĻņµŖĘųÖŠµÄµŖ£¬·½³ĢŹ½ĪŖ£ŗNaNO2 + NH4Cl = NaCl + N2”ü+ 2H2O£»
¹Ź“š°øĪŖ£ŗNaNO2 + NH4Cl = NaCl + N2”ü+ 2H2O£»
(5)”¢°ŃĀČĘųĶص½NaNO2ČÜŅŗÖŠ£¬Éś³ÉNaNO3ŗĶHCl£¬ĀČĘųÖŠC1ŌŖĖŲ»ÆŗĻ¼Ū½µµĶ×÷Ńõ»Æ¼Į£¬NaNO2ÖŠNŌŖĖŲ»ÆŗĻ¼ŪÉżøß×÷»¹Ō¼Į£¬¹Ź·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗNO2-+ Cl2+ H2O = NO3-+ 2Cl-+2H+£»
(6)A”¢ŌŚÖŠ¶¾¹ż³ĢÖŠŃŖŗģµ°°×ÖŠFeŌŖĖŲµÄ»ÆŗĻ¼ŪÉżøߣ¬±»Ńõ»Æ£¬¹ŹAÕżČ·£»
B”¢ÖŠ¶¾Ź±ŃĒĻõĖįÄĘÖŠµÄNŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬×÷Ńõ»Æ¼Į·¢Éś»¹Ō·“Ó¦£¬¹ŹB“ķĪó£»
C”¢Ņ©Ę·ĆĄĄ¶ŌŚ½ā¶¾¹ż³ĢÖŠ£¬ĢåĻÖĘ仹ŌŠŌ£¬×÷»¹Ō¼Į£¬¹ŹCÕżČ·£»
D”¢½ā¶¾Ź±øßĢśŃŖŗģµ°°×µĆµē×Ó×÷Ńõ»Æ¼Į£¬Ńõ»Æ¼Į±»»¹Ō£¬ĖłŅŌ±»»¹ŌĪŖÕż³£ŃŖŗģµ°°×£¬¹ŹDÕżČ·£»
¹ŹŃ”B”£


 ×ß½ųĪÄŃŌĪÄĻµĮŠ“š°ø
×ß½ųĪÄŃŌĪÄĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆę¶ŌČ«Ēņ½üĘŚµÄĘųŗņŅģ³££¬»·¾³ĪŹĢāŌŁ“Ī³ÉĪŖ½¹µć”£SO2”¢NOx”¢CO2ŹĒ¶Ō»·¾³Ó°Ļģ½Ļ“óµÄĘųĢ壬¶ŌĖūĆĒµÄŗĻĄķæŲÖĘŗĶÖĪĄķŹĒÓÅ»ÆĪŅĆĒÉś“ę»·¾³µÄÓŠŠ§Ķ¾¾¶”£
(1)ŅŃÖŖ£ŗH2O(g)=H2O(l)”” ¦¤H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l)”” ¦¤H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2 (g)+3H2O(g)”” ¦¤H3=-Q3 kJ/mol
Ōņ23gŅŗĢ¬¾Ę¾«ĶźČ«Č¼ÉÕ²¢»Öø“ÖĮŹŅĪĀ·Å³öµÄČČĮæĪŖ________________kJ”£
(2)ĻĀ±ķĪŖ·“Ó¦2SO2(g)£«O2 (g)![]() 2SO3(g)µÄĻąÓ¦ĪĀ¶ČĻĀĘ½ŗā³£ŹżµÄŹżÖµ£¬ÓÉ“ĖµĆ³öøĆ·“Ó¦µÄ¦¤H__________0£ØĢī”°>”±”°=”±»ņ”°<”±£©”£
2SO3(g)µÄĻąÓ¦ĪĀ¶ČĻĀĘ½ŗā³£ŹżµÄŹżÖµ£¬ÓÉ“ĖµĆ³öøĆ·“Ó¦µÄ¦¤H__________0£ØĢī”°>”±”°=”±»ņ”°<”±£©”£
T/”ę | 700 | 800 | 830 | 1 000 | 1 200 |
K | 2.6 | 1.9 | 1.0 | 0.7 | 0.6 |
(3)¢ŁŅŃÖŖ£ŗŌŚ2LĆܱÕČŻĘ÷ÖŠ£¬17”ę”¢1.01”Į105PaĢõ¼žĻĀ£¬2NO2(g)![]() N2O4(g) ¦¤H<0µÄĘ½ŗā³£ŹżK=13.3”£µ±“Ė·“Ó¦“ļµ½Ę½ŗāŹ±£¬Čōn(NO2)=0.060mol£¬Ōņc(N2O4)=_______(±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö)”£
N2O4(g) ¦¤H<0µÄĘ½ŗā³£ŹżK=13.3”£µ±“Ė·“Ó¦“ļµ½Ę½ŗāŹ±£¬Čōn(NO2)=0.060mol£¬Ōņc(N2O4)=_______(±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö)”£
¢ŚČōøıäÉĻŹöĢåĻµµÄijøöĢõ¼ž£¬“ļµ½ŠĀµÄĘ½ŗāŗ󣬲āµĆ»ģŗĻĘųĢåÖŠc(NO2)=0.040mol/L£¬c(N2O4)=0.0070mol/L£¬ŌņøıäµÄĢõ¼žŹĒ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆĻĀĮŠŹµŃé×°ÖĆ¼°Ņ©Ę·ÄÜŹµĻÖĻąÓ¦ŹµŃéÄæµÄµÄŹĒ

A. ¼×ÓĆÓŚÖĘČ”NaHCO3¾§Ģå B. ŅŅÓĆÓŚ·ÖĄėI2ŗĶNH4Cl
C. ±ūÓĆÓŚÖ¤Ć÷·Ē½šŹōŠŌĒæČõ£ŗCl>C>Si D. ¶”ÓĆÓŚ²ā¶ØijĻ”“×ĖįµÄĪļÖŹµÄĮæÅضČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦3BrF3 + 5H2O = Br2 + HBrO3 + O2”ü + 9HF£¬µ±Éś³É3 mol Br2Ź±£¬±»Ė®»¹ŌµÄBrF3µÄĪļÖŹµÄĮæĪŖ
A.9 molB.6 molC.4 molD.2 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ¶ĻĮŃ1mol»Æѧ¼üĪüŹÕµÄÄÜĮæ»ņŠĪ³É1mol»Æѧ¼üŹĶ·ÅµÄÄÜĮæ³ĘĪŖ¼üÄÜ£¬²æ·ÖĪļÖŹµÄ¼üÄÜČēĻĀ±ķĖłŹ¾£ŗ
»Æѧ¼ü | C-H | C=O | N-H | C-N | H-O |
¼üÄÜ£ØkJ/mol£© | a | b | c | d | e |
¼×Č©ÖʱøĪŚĀåĶŠĘ·µÄ·“Ó¦ČēĻĀ£¬6![]() (g) + 4NH3(g) ”ś
(g) + 4NH3(g) ”ś  + 6H2O(l)
+ 6H2O(l)
øĆ·“Ó¦µÄØSHĪŖ £Ø £©
A. 6£Øa+b+c-d-e£©kJ/molB. 6£Ød+e-a-b-c£©kJ/mol
C. 6£Øb+2c-2d-2e£©kJ/molD. 6£Ø2d+2a+2e-b-3c£©kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æI. æĘѧ¼ŅŃŠ¾æ³öŅ»ÖÖŅŌĢģČ»ĘųĪŖČ¼ĮĻµÄ”°Č¼ÉÕĒ°²¶»ńĻµĶ³”±£¬Ęä¼ņµ„Į÷³ĢČēĶ¼ĖłŹ¾²æ·Ö(Ģõ¼ž¼°ĪļÖŹĪ“±ź³ö)”£
£Ø1£©¹¤ŅµÉĻæÉÓĆH2ŗĶCO2Öʱø¼×“¼£¬Ęä·“Ó¦ĪŖ£ŗCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)£¬Ä³ĪĀ¶ČĻĀ£¬½«1 mol CO2ŗĶ3 mol H2³äČėĢå»ż²»±äµÄ2 LĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśÉĻŹö·“Ó¦£¬²āµĆ²»Ķ¬Ź±æĢ·“Ó¦Ē°ŗóµÄŃ¹Ēæ¹ŲĻµČēĻĀ£ŗ
CH3OH(g)+H2O(g)£¬Ä³ĪĀ¶ČĻĀ£¬½«1 mol CO2ŗĶ3 mol H2³äČėĢå»ż²»±äµÄ2 LĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśÉĻŹö·“Ó¦£¬²āµĆ²»Ķ¬Ź±æĢ·“Ó¦Ē°ŗóµÄŃ¹Ēæ¹ŲĻµČēĻĀ£ŗ
Ź±¼ä/h | 1 | 2 | 3 | 4 | 5 | 6 |
Pŗó/PĒ° | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
ÓĆH2 ±ķŹ¾Ē°2 hĘ½¾ł·“Ó¦ĖŁĀŹv(H2) £½__________ mol”¤£ØL”¤h)-1”£
£Ø2£©ŌŚ300 ”ę”¢8 MPaĻĀ£¬½«¶žŃõ»ÆĢ¼ŗĶĒāĘų°“ĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć3ĶØČėŅ»ĆܱÕČŻĘ÷ÖŠ·¢Éś(1)ÖŠ·“Ó¦£¬“ļµ½Ę½ŗāŹ±£¬²āµĆ¶žŃõ»ÆĢ¼µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ50%£¬ŌņøĆ·“Ó¦Ģõ¼žĻĀµÄĘ½ŗā³£ŹżKp£½ ________(ÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£¬·ÖŃ¹£½×ÜŃ¹”ĮĪļÖŹµÄĮæ·ÖŹż)”£
£Ø3£©CO2¾“߻ƼÓĒāæÉŗĻ³ÉµĶĢ¼Ļ©Ģž£ŗ2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ¦¤H”£ŌŚ0.1 MPaŹ±£¬°“n(CO2)”Ćn(H2)£½1”Ć3Ķ¶ĮĻ£¬ČēĶ¼ĖłŹ¾ĪŖ²»Ķ¬ĪĀ¶Č(T)ĻĀ£¬Ę½ŗāŹ±ĖÄÖÖĘųĢ¬ĪļÖŹµÄĪļÖŹµÄĮæ(n)¹ŲĻµ£ŗ
C2H4(g)+4H2O(g) ¦¤H”£ŌŚ0.1 MPaŹ±£¬°“n(CO2)”Ćn(H2)£½1”Ć3Ķ¶ĮĻ£¬ČēĶ¼ĖłŹ¾ĪŖ²»Ķ¬ĪĀ¶Č(T)ĻĀ£¬Ę½ŗāŹ±ĖÄÖÖĘųĢ¬ĪļÖŹµÄĪļÖŹµÄĮæ(n)¹ŲĻµ£ŗ
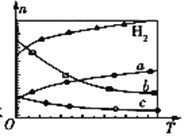
¢ŁøĆ·“Ó¦µÄ¦¤H ______ 0 (Ģī”°£¾”±”¢”°£½”±»ņ”°£¼”±)”£
¢ŚĒśĻßc±ķŹ¾µÄĪļÖŹĪŖ ____________________”£
II. ÉéÓŠĮ½ÖÖ³£¼ūµÄČõĖį£¬ÉéĖį(H3AsO4)ŗĶŃĒÉéĖį(H3AsO3)”£Ä³Š”×éÓūĢ½¾ææÉÄę·“Ó¦AsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O”£Éč¼ĘČēĻĀĶ¼IĖłŹ¾×°ÖĆ”£ŹµŃé²Ł×÷¼°ĻÖĻó:°“Ķ¼I×°ÖĆ¼ÓČėŹŌ¼Į²¢Į¬½Ó×°ÖĆ£¬µēĮ÷ÓÉC2Į÷ČėC1”£µ±µēĮ÷±äĪŖĮ揱£¬ĻņĶ¼I×°ÖĆ×ó±ßÉÕ±ÖŠÖšµĪ¼ÓČėŅ»¶ØĮæ2mol/LµÄŃĪĖį£¬·¢ĻÖÓÖ²śÉśµēĮ÷£¬ŹµŃéÖŠµēĮ÷ÓėŹ±µÄ¹ŲĻµČēĶ¼IIĖłŹ¾”£
AsO43- + 2I- + H2O”£Éč¼ĘČēĻĀĶ¼IĖłŹ¾×°ÖĆ”£ŹµŃé²Ł×÷¼°ĻÖĻó:°“Ķ¼I×°ÖĆ¼ÓČėŹŌ¼Į²¢Į¬½Ó×°ÖĆ£¬µēĮ÷ÓÉC2Į÷ČėC1”£µ±µēĮ÷±äĪŖĮ揱£¬ĻņĶ¼I×°ÖĆ×ó±ßÉÕ±ÖŠÖšµĪ¼ÓČėŅ»¶ØĮæ2mol/LµÄŃĪĖį£¬·¢ĻÖÓÖ²śÉśµēĮ÷£¬ŹµŃéÖŠµēĮ÷ÓėŹ±µÄ¹ŲĻµČēĶ¼IIĖłŹ¾”£
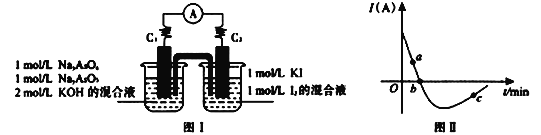
£Ø1£©Ķ¼IIÖŠAsO43-µÄÄę·“Ó¦ĖŁĀŹ:a____b( Ģī”°>”±”¢”°<”±»ņ”°=”± )”£
£Ø2£©Š“³öĶ¼IIÖŠcµć¶ŌÓ¦Ķ¼I×°ÖƵÄÕż¼«·“Ó¦Ź½__________________________”£
£Ø3£©ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ________”£
a.2v(I-)Õż=v(AsO33-)Äęb.ČÜŅŗµÄpH²»ŌŁ±ä»Æ
c.µēĮ÷±ķŹ¾Źż±äĪŖĮć d.ČÜŅŗŃÕÉ«²»ŌŁ±ä»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»ÖÖĘųĢ¬ĶéĢžŗĶŅ»ÖÖĘųĢ¬Ļ©Ģž×é³ÉµÄ»ģŗĻĪļ¹²0.1 mol£¬ĶźČ«Č¼ÉÕµĆ0.16 mol¶žŃõ»ÆĢ¼ŗĶ3.6 gĖ®”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. Ņ»¶ØÓŠ¼×Ķé B. Ņ»¶ØŹĒ¼×ĶéŗĶŅŅĻ© C. æÉÄÜÓŠŅŅĶé D. Ņ»¶ØÓŠŅŅČ²
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÕąĶŗĻ½šŹĒŅ»ÖÖ³£ÓƵıź×¼µē×č²ÄĮĻ£¬¹¤ŅµÉś²śÖŠ»į³öĻÖŅ»Š©¼¼ŹõÖø±ź“ļ²»µ½ŅŖĒóµÄŗĻ½š£¬ĪŖ±ÜĆā׏Ō“ĄĖ·ŃæÉĄūÓĆČēĻĀĮ÷³Ģ¶Ō²»“ļ±źŗĻ½šÖŠµÄÕą”¢Ķ½ųŠŠ»ŲŹÕ£¬Ēė»Ų“šĻą¹ŲĪŹĢā”£
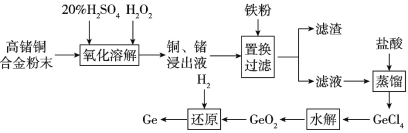
£Ø1£©ÕąŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ____”£
£Ø2£©Ńõ»ÆČܽā¹ż³ĢÖŠĶ²ĪÓė·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ___”£ĪŖ¼ÓæģŃõ»ÆČܽā·“Ó¦ĖŁĀŹæɲÉÓƵēėŹ©ÓŠ___(ČĪŠ“Į½ÖÖ)”£
£Ø3£©ĀĖŌüµÄ³É·ÖŹĒ_____”£
£Ø4£©Ė®½ā¹ż³Ģ·¢ÉśµÄ·“Ó¦ŹĒGeCl4+2H2O=GeO2”ż+4HCl£¬ĪŖµĆµ½“æ¾»µÄGeO2£¬¶ŌĖ®½āĖłµĆ»ģŗĻĪļŅŖ½ųŠŠ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµČ²Ł×÷£¬ÅŠ¶ĻGeO2ŹĒ·ńĻ“µÓøɾ»µÄ²Ł×÷ŹĒ__”£
£Ø5£©ĻĀĮŠ½šŹōµÄŅ±Į¶ŌĄķÓėĮ÷³ĢÖŠÕąµÄŅ±Į¶ŌĄķĻąĖʵďĒ____(ĢīŃ”ĻīŠņŗÅ)”£
A£®ÄĘ B£®ĀĮ C£®Ģś D£®Ņų
£Ø6£©Čōŗ¬Õą6.2£„µÄøßÕąĶŗĻ½šµÄÖŹĮæĪŖ50kg£¬»¹Ō¹ż³ĢÖŠ²ĪÓė·“Ó¦µÄH2Ģå»żĪŖ1.792m3(ŅŃÕŪŗĻĪŖ±ź×¼×“æö)£¬ŌņÕąµÄ»ŲŹÕĀŹĪŖ____(±£ĮōČżĪ»ÓŠŠ§Źż×Ö)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”泬ŅōĖŁ·É»śŌŚĘ½Į÷²ć·ÉŠŠŹ±£¬Ī²ĘųÖŠµÄNO»įĘĘ»µ³ōŃõ²ć”£æĘѧ¼ŅÕżŌŚŃŠ¾æĄūÓĆ“ß»Æ¼¼Źõ½«Ī²ĘųÖŠµÄNOŗĶCO×Ŗ±ä³ÉCO2ŗĶN2£¬Ęä·“Ó¦ĪŖ£ŗ2NO£«2CO![]() 2CO2£«N2”£¼ŁÉč³£ĪĀĻĀŌŚŗćČŻµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ŹŌ½ā“šĻĀĮŠĪŹĢā£ŗ
2CO2£«N2”£¼ŁÉč³£ĪĀĻĀŌŚŗćČŻµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ŹŌ½ā“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÉĻŹöĢõ¼žĻĀøĆ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦µÄ¦¤H_____0£ØĢīŠ“”°£¾”±”¢”°£¼”±”¢”°£½”±£©”£
£Ø2£©ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ____________”£
A£®»ģŗĻĘųĢåµÄŃ¹Ēæ±£³Ö²»±ä
B£®N2µÄÅØ¶Č²»ŌŁøıä
C£®ĻūŗÄCOµÄĪļÖŹµÄĮæÓėÉś³ÉCO2µÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć1
D£®NO”¢CO”¢CO2”¢N2µÄĪļÖŹµÄĮæÖ®±ČĪŖ2”Ć2”Ć2”Ć1
£Ø3£©¼ČŅŖ¼Óæģ·“Ó¦ĖŁĀŹÓÖŅŖĢįøßNO×Ŗ»ÆĀŹ£¬ĻĀĮŠ“ėŹ©æÉŠŠµÄŹĒ____________”£
””A£®Ń”ÓĆøüÓŠŠ§µÄ“߻ƼĮ B£®Éżøß·“Ó¦ĢåĻµµÄĪĀ¶Č
””C£®½µµĶ·“Ó¦ĢåĻµµÄĪĀ¶Č D£®ĖõŠ”ČŻĘ÷µÄĢå»ż
£Ø4£©ĪŖĮĖ²ā¶ØŌŚÄ³Ö֓߻ƼĮ×÷ÓĆĻĀµÄ·“Ó¦ĖŁĀŹ£¬Ä³æĘѧ¼ŅŌŚÄ³ĪĀ¶ČĻĀÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äµÄNOŗĶCOÅضČČē±ķ£Ø¾ł²»æ¼ĀĒĪĀ¶Č±ä»Æ¶Ō“߻ƼĮ“߻Ɗ§ĀŹµÄÓ°Ļģ£©£ŗ
Ź±¼ä(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) ( molL£1) | 1.00”Į10£3 | 4.50”Į10£4 | 2.50”Į10£4 | 1.50”Į10£4 | 1.00”Į10£4 | 1.00”Į10£4 |
c(CO) ( molL£1) | 3.60”Į10£3 | 3.05”Į10£3 | 2.85”Į10£3 | 2.75”Į10£3 | X | 2.70”Į10£3 |
“Ó±ķÖŠŹż¾Ż·ÖĪöæÉÖŖ£ŗ
¢ŁX£½____________mol”¤L£1£»
¢ŚĒ°2sÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹv(N2)£½________________________mol”¤L£1”¤s£1£»
¢ŪøĆĪĀ¶ČĻĀ·“Ó¦µÄĘ½ŗā³£ŹżK£½________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com