
【题目】下列电离方程式中正确的是( )
A.KOH═K++OH﹣ B.NaHCO3═Na++H++CO32﹣
C.H2SO4═2H++SO42﹣ D.Fe2(SO4)3═Fe23++3SO42﹣
 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.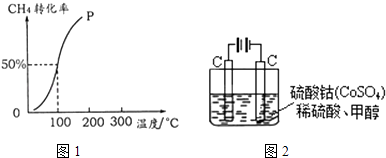
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氯气可用于合成药物B.SO2环境污染大,工业生产中没有价值
C.纯碱在造纸工业中有着重要的应用D.硫酸铜可作泳池池水消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 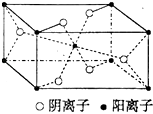
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
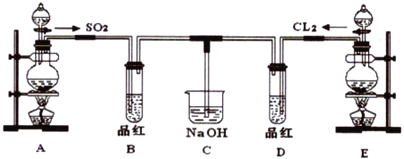
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_________________________________________。
(2)实验室用装置E制备Cl2,其反应化学化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①指出该反应中在反应中HCl(浓)所表现出的化学性质_____________、___________。
②请把(2)中的化学方程式改写为离子方程式_______________________________________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项,下同。
A.品红都褪色 B.品红都不褪色
C.试管B 中品红褪色D 中不褪色 D.试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为__________。
A.无色 红色 B.无色 无色 C.红色 红色 D.红色 无色
(4)C 烧杯氢氧化钠溶液的作用是________________________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=﹣lg c[OH﹣])与pH的变化关系如图所示,则( ) 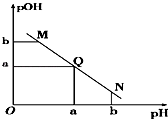
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO﹣)>c(Na+)
C.M点和N点所示溶液中水的电离程度不相同
D.Q点消耗NaOH溶液的体积小于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO﹣+H2OCH3COOH+OH﹣ , 使得溶液中的c(OH﹣)>c(H+)
B.在常温下,10 mL 0.2 molL﹣1盐酸与10 mL 0.2 molL﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13
C.在0.1 molL﹣1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl﹣)
D.5 mL 1 molL﹣1 CH3COONa溶液与5 mL 1 molL﹣1盐酸混合液中c(Cl﹣)=c(Na+)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A.pH相等的①NH4Cl溶液、②(NH4)2SO4溶液、③NH4HSO4溶液,溶液中c(NH4+)的大小顺序为①>②>③
B.pH相等的NaF溶液与CH3COOK溶液:[c(Na+)﹣c(F﹣)]>[c(K+)﹣c(CH3COO﹣)]
C.0.2 mol?L﹣1Na2CO3溶液:c(OH﹣)=c(HCO![]() )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
D.0.2 mol?L﹣1盐酸与0.1 mol?L﹣1NaAlO2溶液等体积混合:c(Cl﹣)>c(Na+)>c(Al3+)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气溶于水:Cl2+H2O==2H++Cl-+ClO-
B. 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-=2Fe2++I2
C. 酸性溶液中KBrO3与KBr反应生成Br2:BrO3-+Br-+6H+=Br2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+ Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com