
| A. | 1molCO的质量是28g | B. | HNO3的摩尔质量63g | ||
| C. | ${\;}_{53}^{131}$I 的中子数为53 | D. | H2O和Al3+的核外电子总数不同 |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol羧酸B在光照条件下最多可与4mol氯气发生取代反应 | |
| B. | l酯A只能在碱性溶液中才能水解 | |
| C. | 1mol酯A最多可与2mol NaOH溶液发生反应 | |
| D. | 题中酸也能燃烧可知有机物均可在氧气中点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
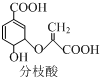
| A. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3molNaOH发生中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中,所有酸和碱发生中和反应放出的热量都叫中和热 | |
| B. | 在稀溶液中1mol酸和1mol碱反应放出的热量不一定相等 | |
| C. | 含1molBa(OH)2的稀溶液和1mol稀硫酸完全反应放出的热,即为中和热 | |
| D. | 将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,放出的热量为57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com