
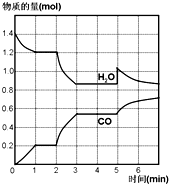
 ��һ�ݻ�Ϊ2L���ܱ������У������·������з�Ӧ��C��s��+H2O��g��?CO��g��+H2��g��������H2O��CO�����ʵ�����mol����ʱ�䣨min���ı仯������ͼ��ʾ��
��һ�ݻ�Ϊ2L���ܱ������У������·������з�Ӧ��C��s��+H2O��g��?CO��g��+H2��g��������H2O��CO�����ʵ�����mol����ʱ�䣨min���ı仯������ͼ��ʾ������ ��1������v��CO��=$\frac{\frac{��n}{V}}{��t}$����1min�ڦԣ�CO����
��2��ͼ���������ˮ��һ����̼���ʵ��������ʱ���Ϊƽ��״̬��
��3����Ӧ������2minʱ������ͼ��֪����ͬʱ���ڣ�ˮ��һ����̼�����ʵ����仯������0-1min�ڣ�˵����Ӧ����������ѹǿ���¶ȶԷ�Ӧ���ʡ���ѧƽ���Ӱ�������
��4����Ӧ����5minʱ��CO�����ʵ������䣬ˮ�����ʵ�������˵���ı������ˮ�����ʵ�����
��� �⣺��1����������֪��1minʱCO�����ʵ����仯Ϊ0.2mol��1min�ڦԣ�CO��=$\frac{\frac{0.2mol}{2L}}{1min}$=0.1mol/��L•min����
�ʴ�Ϊ��0.1mol/��L•min����
��2����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȡ������Ȳ��ٷ����仯���Լ��ɴ����������������䣬���ɴ��ж�1��2 min��3��5 minʱ��η�Ӧ�ﵽƽ��״̬��
�ʴ�Ϊ��1��2 min��3��5 min��
��3����Ӧ������2minʱ������ͼ��֪�������¶Ⱥ�CO���ʵ�������˵��ƽ��������У�����ӦΪ���ȷ�Ӧ�����淴ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ���ţ�
��4����Ӧ����5minʱ��CO�����ʵ������䣬ˮ�����ʵ�������˵���ı����������ˮ�����ʵ������淴Ӧ����ˮ������С��һ����̼����ƽ��������У�
A��C�ǹ��壬����C������Ӱ�컯ѧƽ�⣬��A����
B��������ˮ������5minʱCO�����ʵ������䣬ˮ�����ʵ���������ͼ��仯һ�£���B��ȷ��
C����Ӧ�����ȷ�Ӧ���������¶�ƽ��������У�ˮ�����ʵ�������CO�����ʵ�����С����ͼ��仯��һ�£���C����
D��������ѹǿ��ƽ��������У�ˮ�����ʵ�������CO�����ʵ�����С����ͼ��仯��һ�£���D����
�ʴ�Ϊ��B��
���� ���⿼�����ϵļ��㣬��Ŀ�Ѷ��еȣ��漰��ѧƽ��״̬���жϡ���������Ի�ѧƽ���Ӱ�죬��ȷ��ѧƽ��״̬���ж����ݡ��¶Ⱥ����ʵ�Ũ�ȶԻ�ѧƽ���Ӱ�켴�ɽ��ע�⽵���¶�ʱ�����������ȷ�Ӧ���Ƿ��ȷ�Ӧ�������ͷ�Ӧ���ʣ�����������ѧ���ķ������������Ӧ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���Ļ����������������й㷺���ڣ�
���Ļ����������������й㷺���ڣ� ����ͨ����ӦNH3��g��+Cl2��g��=NH2Cl��g��+HCl��g���Ʊ��Ȱ�����֪���ֻ�ѧ���ļ������±���ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�ġ�H=+11.3kJ•mol-1��
����ͨ����ӦNH3��g��+Cl2��g��=NH2Cl��g��+HCl��g���Ʊ��Ȱ�����֪���ֻ�ѧ���ļ������±���ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�ġ�H=+11.3kJ•mol-1��| ��ѧ�� | ����/��kJ•mol-1�� |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n��NO������������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n��NO������������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n��NO������������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���������� | ���� |
| A | ��0.1mol•L-1��ˮϡ�ͳ�0.01mol•L-1�����pH��11.1���10.6 | ϡ�ͺ�NH3•H2O�ĵ���̶ȼ�С |
| B | ��ͭƬ��пƬ�õ������Ӻ���ϡ�����У�ͭƬ�������ݲ��� | ��п�������£�ͭ�����ᷴӦ�������� |
| C | ��25mL��ˮ�ͷ�ˮ�зֱ����5��FeCl3������Һ��ǰ��Ϊ��ɫ������Ϊ���ɫ | �¶����ߣ�Fe3+��ˮ��̶����� |
| D | ������CaSO4����Na2CO3������Һ�У�һ��ʱ��������ɷ�ΪCaCO3 | ͬ�����ܽ�ȣ�CaSO4��CaCO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͭ�����������ǵ���� | |
| B�� | Fe��OH��3������ɫ�������ܷ������������ | |
| C�� | H2��SO2��CO2�������嶼����Ũ������� | |
| D�� | SiO2���ܺ�����������Һ��ӦҲ�ܺͰ����ᷴӦ������������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com