
| A. | KCl | B. | Cu2(OH)2CO3 | C. | Na2CO3 | D. | NaOH |
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:解答题
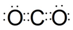 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有12mol(NH4)2SO4分解 | B. | 有6mol原子被还原 | ||
| C. | 生成2mol氧化产物 | D. | 生成7molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验室制氧 | 用石灰石和稀盐酸制取 CO2 | 蒸馏 | 溶液转移 |
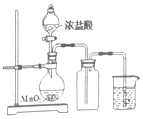 | 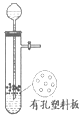 |  |  |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
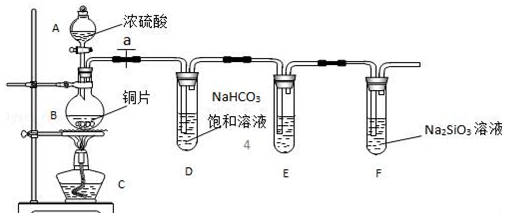
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸干AlCl3溶液,无法得到无水AlCl3 | |
| B. | 用稀H2SO4洗涤BaSO4沉淀,可减少沉淀损失量 | |
| C. | 氯水中加入少量CaCO3粉末,可以提高漂白能力 | |
| D. | 滴加CuSO4溶液可以加快Zn与稀H2SO4反应的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com