
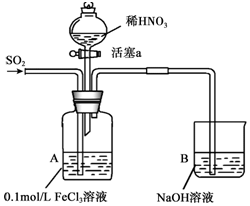
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
分析 (1)铁离子水解溶液呈酸性,加入盐酸,增大氢离子浓度,抑制铁离子水解;
(2)Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快,铁离子氧化二氧化硫反应缓慢,但是反应限度较大,使溶液中Fe3+浓度降低,生成Fe(SO2)63+的平衡逆向移动;
(3)加入KSCN溶液后溶液不变色,说明铁离子完全转化为亚铁离子,再加入BaCl2溶液产生白色沉淀,氧化生成硫酸根与钡离子结合为硫酸钡;
(4)硝酸具有强氧化性,将溶液中亚铁离子氧化为铁离子;
(5)反应生成的NO与氧气反应生成二氧化氮;
(6)氧化剂的氧化性强于氧化产物的氧化性.
解答 解:(1)铁离子水解:Fe3++3H2O Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解,
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解,
故答案为:铁离子水解:Fe3++3H2O Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解;
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解;
(2)Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液,
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液,
故答案为:Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液;
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液;
(3)加入KSCN溶液后溶液不变色,说明铁离子完全转化为亚铁离子,再加入BaCl2溶液产生白色沉淀,氧化生成硫酸根与钡离子结合为硫酸钡,反应离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓;
(4)硝酸具有强氧化性,将溶液中亚铁离子氧化为铁离子,浅绿色溶液变为黄色,反应离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)反应生成的NO与氧气反应生成二氧化氮,发生反应的方程式是:2NO+O2=2NO2,
故答案为:2NO+O2=2NO2;
(6)实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-,
故答案为:NO3->Fe3+>SO42-.
点评 本题考查物质性质的探究实验,涉及离子检验、化学平衡、方程式书写、氧化还原反应等,侧重对原理的考查与分析,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:多选题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为υ(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中的反应物转化率比容器Ⅱ中的大 | |
| C. | 三个容器中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 达若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 150 mL 1 mol•L-1的NaCl | B. | 75 mL 1.5mol•L-1的CaCl2 | ||
| C. | 150 mL 3 mol•L-1的KCl | D. | 75 mL 2 mol•L-1的NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 71gCl2所含原子数为NA | |
| C. | 在常温常压下,1molNe含有的原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O | |
| C. | 向苯酚钠溶液中通入少量CO2: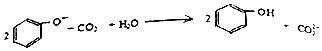 | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101kPa下氢气的燃烧热△H=-285.8 kJ•mol-1,则水分解的热化学方程式:2 H2O (l)=2H2 (g)+O2 (g)△H=+285.8 kJ•mol-1 | |
| C. | Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-2akJ•mol-1,则任何强酸和强碱发生中和反应生成1molH2O(l)的反应热均为-akJ•mol-1 | |
| D. | 1g甲烷完全燃烧生成液态水的过程中放出55.6kJ热量,则CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com