
【题目】下列离子方程式书写正确的是( )
A.制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-=CaCO3+SO42-
C.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O =2Al(OH)3↓+3CO2↑
D.碳酸钠溶液显碱性:CO32-+2H2OH2CO3+2OH-
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】简单化合物HB在水中达到电离平衡时各种微粒的浓度如下表所示(25 ℃):分析表中①至⑥的数据,下列说法不正确的是( )

A.①与②的数据都说明化合物HB只有部分电离
B.③与④的数据近似相等,说明HB的电离平衡常数与初始浓度无关
C.⑤与⑥的数据说明加水稀释后HB的电离平衡正向移动
D.⑤与⑥的数据说明起始浓度越大,HB电离的程度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、NH4+、S2-、ClO-
B.与Al反应能产生H2的溶液中:Na+、Cu2+、NO3-、I-
C.使甲基橙变红的溶液:Na+、NH4+、SO32-、Cl-
D.![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。

①仪器a的名称为___________。
②无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为_____________。
③装置B的主要作用是_____________。
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
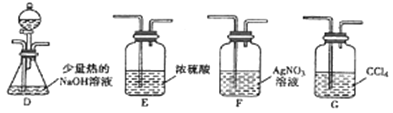
①乙组同学的实验装置中,依次连接的合理顺序为A→B→_____→_____→_____。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞先后加入两种试剂,观察实验现象。分液漏斗中先后加入的试剂是_______________。
③能证明CH3Cl中含有氯元素的实验现象是____________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3Cl中的卤素原子。相关数据如下表:
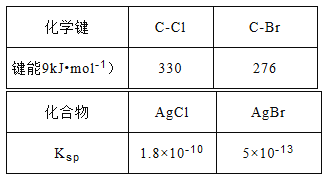
将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼![]() 是无色、有强还原性的液体,实验室制备水合肼的原理为
是无色、有强还原性的液体,实验室制备水合肼的原理为![]() 据此,某学生设计了下列实验.
据此,某学生设计了下列实验.
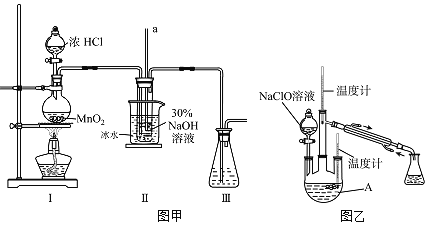
(制备NaClO溶液)实验装置如图甲所示![]() 部分夹持装置已省略
部分夹持装置已省略![]()
已知:3NaClO![]()
![]()
(1)配制![]() 溶液时,所需玻璃仪器除量筒外还有______
溶液时,所需玻璃仪器除量筒外还有______![]() 填字母
填字母![]() 。
。
A.容量瓶![]() 烧杯
烧杯![]() 移液管
移液管![]() 玻璃棒
玻璃棒
(2)装置Ⅰ中发生的离子反应方程式是______;Ⅱ中玻璃管a的作用为______;为了提高NaClO的产率,需对Ⅰ中产生的![]() 进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在
进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在![]() 以下,其主要目的______。
以下,其主要目的______。
(制取水合肼)实验装置如图乙所示
(3)仪器A的名称为______;反应过程中,如果分液漏斗中溶液的滴速过快,部分![]() 参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(测定肼的含量)
(4)称取馏分![]() ,加水配成
,加水配成![]() 溶液,在一定条件下,用
溶液,在一定条件下,用![]() 的
的![]() 溶液滴定.已知:
溶液滴定.已知:![]()
![]() 滴定时,可以选用的指示剂为______;
滴定时,可以选用的指示剂为______;
![]() 实验测得消耗
实验测得消耗![]() 溶液的平均值为
溶液的平均值为![]() ,馏分中
,馏分中![]() 的质量分数为______。
的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 微溶于水,可溶于硝酸。溶液X中可能含有
微溶于水,可溶于硝酸。溶液X中可能含有![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
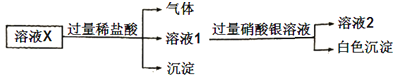
下列说法正确的是( )
A.溶液X中一定含有![]()
![]() 和
和![]()
B.溶液X中一定不含![]() 、
、![]()
C.为确定溶液X中是否含有![]() ,可取溶液2,加入
,可取溶液2,加入![]() 溶液
溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是
等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是![]()

A.该混合物一定是![]() 和NaCl
和NaCl
B.该混合物可能是![]() 和KCl
和KCl
C.该混合物一定是![]() 和NaCl
和NaCl
D.该混合物可能是![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解, 放出1. 344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0. 24 molB.0. 21 molC.0. 16 molD.0. 14 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,0.1 mol/L的NH4HCO3溶液pH=7.8。往碳酸的饱和水溶液中通入NH3,测得含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法错误的是 ( )
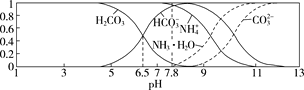
A.常温下,Kb(NH3·H2O)>Ka1(H2CO3)
B.向pH=6.5的上述溶液中通入NH3时,NH4+和HCO3-浓度都逐渐减小
C.NH4HCO3溶液中存在关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com