

| A. | SiO2 | B. | Si | C. | H2Si03 | D. | Na2SiO3 |
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸性溶液中:Na+、CO32-、NH4+、NO3- | |
| B. | 无色溶液中:Cl-、H+、Cu2+、SO42- | |
| C. | 使石蕊试液变蓝的溶液中:CO32-、Na+、MnO4-、K+ | |
| D. | 含SCN-的溶液中:K+、NH4+、Cl-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
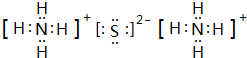 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com