
【题目】对三联苯是一种有机合成的中间体。工业上合成对三联苯的化学方程式为
![]()
下列说法中不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯的一氯取代物有3种
C. 1 mol对三联苯在足量的氧气中完全燃烧消耗21.5 mol O2
D. 对三联苯分子中至少有16个原子共平面
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。
实验 | 实验及操作 | 现象 | |
| 试管 | 滴管 | |
I.饱和Na2SiO3溶液(含2滴酚酞) | 先滴加1.0ML0.5mol/LNaOH溶液;再滴加1.0mol/LH2SO4溶液 | 红色溶液中出现胶状沉淀 | |
II.0.1mol/LAlCl3溶液 | 加碱时______;加酸时产生白色沉淀,又逐渐溶解至消失 | ||
Ⅲ.0.1mol/LFe(NO3)2溶液 | 加碱时______;加酸后得黄色溶液 | ||
Ⅳ.新制饱和氯水 | 加碱时溶液变为无色;加酸后______。 | ||
(1)用离子方程式解释现象1中出现胶状沉淀的原因:______________。
(2)II中加碱时出现的现象是__________,现象说明溶液中发生反应的离子方程式是________。
(3) Ⅲ中加碱时出现的现象是______________。
(4)IV中加酸时出现的现象是_________,用离子方程式解释产生此现象的原因_________。
(5)滴加试剂顺序的变化。会影响溶液中的现象和发生的反应。请继续分析以下实验。
实验 | 实验及操作 | 现象 | |
| 试管 | 滴管 | |
0.1mol/LFe(NO3)2溶液 | 先滴加1.0mol/LH2SO4溶液;再滴加1.0mL0.5mol/LNaOH溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 | |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL0.1mol/L Fe(NO3)2溶液中____________,如果溶液变红色。说明溶液中含Fe3+,证明加酸时溶液中发生了反应。(请将上述操作补充充整)
②推测溶液中产生Fe3+的可能原因有两种:
I.__________________;Ⅱ.______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
(1)在如图所示仪器中,配制上述溶液肯定不需要的是(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 . 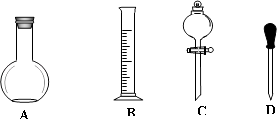
(2)在容量瓶的使用方法中,下列操作不正确的是 .
A.容量瓶洗涤后残留少量水不影响使用
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制NaOH溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制硫酸溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀.
(3)用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(保留到小数点后1位.),若实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关家蚕活细胞的叙述正确的是
A. 化学元素含量的高低是0>C>N>H B. 含量最多的化合物是蛋白质
C. 脂肪是良好的储能物质 D. DNA和RNA都是遗传物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成生物的元素和化合物的说法,正确的是
A. 细胞中的微量元素因含量极少而不如大量元素重要
B. 生物界和非生物界在元素组成的种类和含量上都相同
C. 细胞中的无机盐多以化合物形式存在
D. 植物缺乏N和Mg,将导致叶绿素不能合成,叶片颜色变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种金属性质比较:①甲的单质熔、沸点比乙的低;②常温下,甲能与水反应放出氢气而乙不能;③最高价氧化物对应的水化物碱性比较,甲比乙的强;④在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多。上述项目中能够说明甲比乙的金属性强的是( )
A. ①② B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.离子晶体的晶格能越大离子键越强
B.阳离子的半径越大则可同时吸引的阴离子越多
C.通常阴、阳离子的半径越小、所带电荷数越多,该阴、阳离子组成的离子化合物的晶格能越大
D.拆开1mol离子键所需的能量为该离子晶体的晶格能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于非晶体的叙述错误的是( )
A.玻璃属于非晶体
B.内部微粒的排列是长程无序和短程有序的
C.非晶体材料的所有性能都优于晶体材料
D.金属形成的合金也有非晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com