
【题目】化合物M(结构式如图所示)是常用的还原剂,由H·C·Brown和Schlesinger于1942年在芝加哥大学发现。其中X、Y、Z是原子序数依次减小的不同短周期主族元素,X与W、Z与W均能形成原子个数比为1:1和2:1的化合物,W原子的最外层电子数是电子层数的3倍。下列叙述正确的是
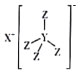
A.Z元素位于第三周期第Ⅶ A族
B.Y的最高价氧化物对应的水化物是一种一元弱酸
C.X和Z形成的化合物的水溶液呈酸性
D.化合物M不能与Z2W2反应
【答案】B
【解析】
W原子的最外层电子数是电子层数的3倍,说明W为O;X与W、Z与W均能形成原子个数比为1:1和2:1的化合物,且X、Y、Z是原子序数依次减小,可知X为Na,Z为H,根据X、Y、Z形成的化合物的结构可知Y为B,由此进行分析判断。
由分析可知W为O,X为Na,Y为B,Z为H;
A. Z为H,位于周期表第一周期第IA族,A项错误;
B. Y为B,其最高价氧化物对应的水化物是H3BO3,是一种一元弱酸,B项正确;
C. X为Na,Z为H,X和Z形成的化合物为NaH,与水反应生成NaOH和H2,溶液呈碱性,C项错误;
D. 化合物M为NaBH4,具有较强的还原性,H2O2属于常见的氧化剂,二者之间可以发生氧化还原反应,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. l00g 9%的葡萄糖水溶液中氧原子数为0.3 NA
B. 标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C. 工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
D. 常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,由四种元素组成的单质或化合物A、B、C、D、E、F、G之间的相互转化关系如图所示(反应条件已略去),其中仅B为单质,D为淡黄色固体,A广泛存在于沼气中。下列说法不正确的是( )

A.简单离子半径:Z>W
B.简单氢化物的稳定性:Z>Y
C.D、F、G中所含的化学键类型完全相同
D.1molD分别与足量C或E反应时,转移的电子数目均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为某同学设计的原电池装置
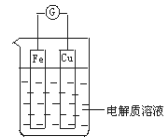
(1)当电解质溶液为稀硫酸时:
①Fe电极是_______(填“正”或“负”)极,其电极反应为_______
②Cu电极的电极反应为_________,该电极发生______反应(填“氧化”或“还原”)反应。原电池工作一段时间后,铁片的质量减少了2.8克,铜片表面产生气体____L(标准状况下),导线中通过_____mol电子。
(2)当电解质溶液为稀硝酸时:
①Fe电极是______极,其电极反应为________________,
②Cu电极是_____极,其电极反应为_________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
③H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则下列说法正确的是
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D. 2molH2(g)在足量氧气中完全燃烧生成气态水放出热量大于571.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物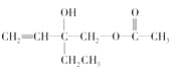 具有手性,发生下列反应后,分子仍有手性的是( )
具有手性,发生下列反应后,分子仍有手性的是( )
①与H2发生加成反应 ②与乙酸发生酯化反应 ③发生水解反应 ④发生消去反应
A. ①② B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)
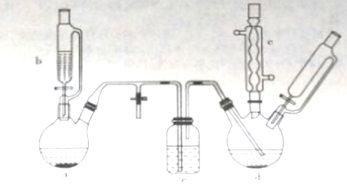
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是__________,用离子方程式表示产生该现象的原因:_______________。
(2)仪器b外侧玻璃导管的作用是_____________。
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是_________,其盛装的试剂名称是_____________。
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是____________。
(4)仪器c的作用是______________。
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如下表:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集_________℃作用的馏分。
(6)实际工业生产中,苯的流失如下表:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13t苯,则制得氯苯________t(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com