
| X | ||
| M |
 N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;分析 W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,则Z和M位于同一主族,根据元素在周期表中的位置知,X位于第二周期,M位于第三周期,最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素、X为C元素,M是S元素,Z和M位于同一主族,则Z是O元素,Y是N元素,Q为Cl元素,Z与W形成的4核离子,则W是H元素,结合物质结构性质解答.
解答 解:W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,则Z和M位于同一主族,根据元素在周期表中的位置知,X位于第二周期,M位于第三周期,最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素、X为C元素,M是S元素,Z和M位于同一主族,则Z是O元素,Y是N元素,Q为Cl元素,Z与W形成的4核离子,则W是H元素,
(1)W2、Z2分别为H2、O2,Q2为Cl2,H2与O2反应生成化合物甲为H2O,H2与Cl2反应生成化合物乙为HCl,已知:HCl(g)+O2(g)→H2O(g)+Cl2(g),每生成1mol Cl2放热57.8kJ,则该反应的热化学方程式为:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol,
故答案为:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应生成硝酸铵,水解显酸性,水解离子反应为NH4++H2O?NH3.H2O+H+,水解程度很小,水解显酸性,则离子浓度大小关系为c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:NH4++H2O?NH3.H2O+H+;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(3)C、N可分别与O以原子个数比1:1形成化合物丙和丁,丙是CO、丁是NO,在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊,根据化合价变化知,戊是CO2,根据反应物、生成物及反应条件知其反应方程式为:2CO+2NO N2+2CO2,该反应的平衡常数表达式为:K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$,
N2+2CO2,该反应的平衡常数表达式为:K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$,
故答案为:2CO+2NO N2+2CO2;K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2;K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
(4)将1molCO气体和1molNO气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
①若气体体积较原来减少23%,则混合气体减少物质的量为:(1mol+1mol)×23%=0.46mol,则:
2CO+2NO N2+2CO2 气体物质的量减少
N2+2CO2 气体物质的量减少
2 1
n(NO) 0.46mol
故n(NO)=$\frac{0.46×2}{1}$=0.92mol,
则NO的转化率=$\frac{0.92}{1}$×100%=92%,
故答案为:92%;
②该反应为放热反应,温度升高,平衡向着逆向移动,反应物浓度增大、生成物浓度减小,则K减小,
故答案为:变小;
③增大压强,化学平衡正向移动,所以再次达平衡后,混合气体中NO的体积分数将减小,
故答案为:变小;
(5)X的最简单气态氢化物为甲烷、Z的单质为氧气,由甲烷、氧气和KOH溶液组成的新型燃料电池中,甲烷发生氧化反应,在负极失去电子,碱性条件下生成碳酸根与水,负极上发生的电极反应式为:CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,涉及热化学方程式的书写、化学平衡的移动以及计算等知识点,根据原子结构结合元素周期律来分析解答,属于综合知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③② | C. | ④② | D. | ③① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝原子核外有13种不同运动状态的电子 | |
| B. | 前四周期元素中,基态原子中成对电子数与其所在周期数相同的元素有6种 | |
| C. | 第一电离能介于B、N之间的第二周期元素有3种 | |
| D. | HF的水溶液中存在4种氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
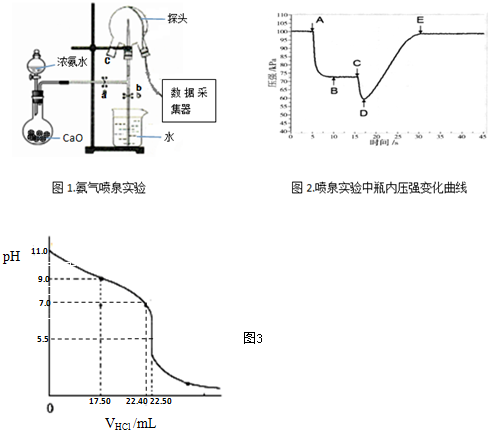
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
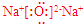
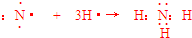 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
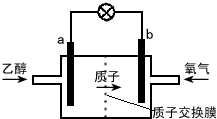
| A. | a极为电池的负极,该电极发生氧化反应 | |
| B. | 电池工作时电子由a极流出沿导线经灯泡到b极 | |
| C. | 电池正极的电极反应式为 O2+2H2O+4e-═4OH- | |
| D. | 电池工作时,1mol乙醇被氧化转移12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
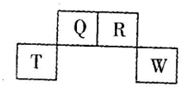
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中只有共价键没有离子键 | |
| D. | Q可形成多种含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| B | Fe | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| C | Mg | 0.1 | 3mol•L-1硫酸 | 10mL | 25℃ |
| D | Mg | 0.1 | 6mol•L-1硝酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com