
【题目】下图所示为石蜡油分解的实验装置。在试管①中加入石蜡油和氧化铝;试管②放在冷水中;试管③中加入酸性高锰酸钾溶液;试管④中加入溴水。分析实验完成下列各题:
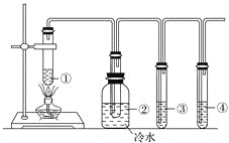
分析实验回答下列问题:
(1)试管①中加入氧化铝的作用是____________________________________________。
(2)试管②内看到的实验现象是______________________________________________。
(3)试管③中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(4)试管④中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(5)通过本实验说明______________________________________________________。
【答案】 催化作用 有油状液体生成 酸性高锰酸钾溶液褪色 氧化 溴水褪色 加成 石蜡油催化裂化有烯烃生成
【解析】石蜡的催化分解就是石蜡的催化裂化,烷烃催化裂化生成烯烃和烷烃,①氧化铝能加快石蜡油的分解速率,从而减少反应时间;②烷烃催化裂化生成烯烃和烷烃,冷却后变成液态;③烯烃不稳定,易被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;④烯烃较活泼,能和溴发生加成反应;⑤通过本实验说明石蜡油催化裂化有烯烃生成。
石蜡的催化分解就是石蜡的催化裂化,烷烃催化裂化生成烯烃和烷烃,(1)氧化铝能加快石蜡油的分解速率而作催化剂,从而减少反应时间,故答案为:催化剂;(2)烷烃催化裂化生成烯烃和烷烃,冷却后变成液态,看到的现象是有油状液体生成,故答案为:有油状液体生成;(3)烯烃不稳定,易被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,发生氧化反应,所以看到的现象是溶液褪色,故答案为:高锰酸钾溶液褪色;氧化;(4)烯烃中含有碳碳双键,所以较活泼,能和溴发生加成反应而使溴水褪色,该反应为加成反应;(5)通过本实验说明石蜡油催化裂化有烯烃生成。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】密闭容器中有如下反应:L(s)+aG(g) ![]() bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
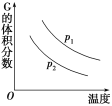
A.正反应为放热反应
B.G的转化率随温度升高而减小
C.化学方程式中的计量数a>b
D.增大压强,容器内气体质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到平衡状态
B. b点与a点相比,c(NO2)、c(N2O4)均减小
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾晶体化学式为:KxFey(CN)znH2O,俗称黄血盐,常用作食品抗结剂。一种用NaCN(N显-3价)废液制取黄血盐的主要工艺流程:
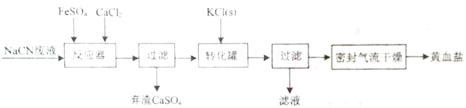
(1)实验室用绿矾固体配制FeSO4溶液时,应先________,再用蒸馏水稀释。
(2)“转化罐”中生成黄血盐晶体的反应类型为________。
(3)采用密封气流干燥取代在通风橱内干燥的原因是________。
(4)黄血盐的化学式可通过下列实验测定:
①准确称取4.220g样品加入水中充分溶解,将所得溶液转移至容量瓶配制成100.00mL溶液A。
②量取25.00mL溶液A,用2.000molL-1KMnO4溶液滴定,达到滴定终点时,共消耗KMnO4溶液15.25mL。反应如下(未配平):![]() ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
通过计算确定样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)Mn3+基态核外电子排布式为____。
(2)NO![]() 的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
(3)配合物[Mn(CH3OH)6]2+中配位原子是__。
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为___。
(5)MnS晶体具有α、β、γ三种形态,其中β-MnS的晶胞结构如图所示,则Mn2+的配位数为____。
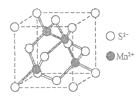
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、F为金属单质,C是淡黄色粉末,M有磁性,回答下题。
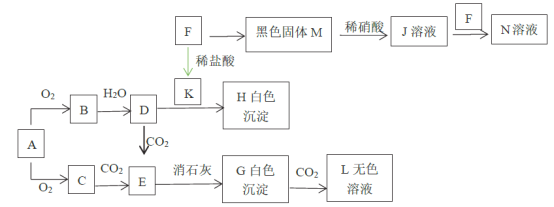
已知:2Na2O2+2CO2=2Na2CO3+O2
(1)写出下列物质的化学式。C____________L_______
(2)用玻璃棒蘸取少量无水CuSO4与熔化的A接触,瞬间产生耀眼的火花,同时有红色物质生成,写出该反应的化学反应方程式__________,在该反应中,氧化剂是____________。
(3)已知氧化性:HNO3>Fe3+,稀硝酸的还原产物是NO,写出固体M与稀硝酸反应的离子方程式________。
(4)写出J与F混合的化学反应方程式:_______。
(5)写出L与足量的D反应的离子方程式:__________。
(6)向1 L 0.2 mol/L的D溶液中通入CO2气体3.36 L(标准状况),所得溶液中的溶质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产与人类进步紧密相联。下列有关说法不正确的是
A. 空气吹出法提取海水中溴通常使用SO2作还原剂
B. 侯氏制碱法工艺流程中利用了物质溶解度的差异
C. 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D. 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com