
| A、焰色反应 | B、盐酸 |
| C、氢氧化钠溶液 | D、水 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
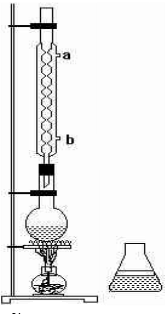
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱式滴定管用蒸馏水洗净后,直接加入未知浓度的NaOH溶液 |
| B、锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C、滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D、滴定前读数正确,达到滴定终点后,俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗涤后,又用标准液润洗 |
| B、滴定过程中锥形瓶中振荡,有液体溅出 |
| C、滴定完毕,滴定管尖端外挂有液滴 |
| D、滴定前仰视读数,滴定终点俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管尖嘴部分有气泡,滴定后消失 |
| B、滴定终点读数时俯视读数 |
| C、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| D、锥形瓶水洗后未干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
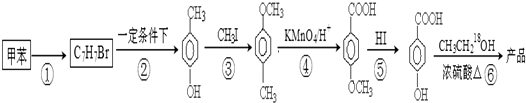
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
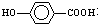
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)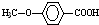 的同分异构体很多,其中符合下列条件有
的同分异构体很多,其中符合下列条件有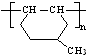 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的硝酸跟pH=11的氢氧化钾溶液 |
| B、pH=3的盐酸跟pH=11的氨水 |
| C、0.1mol/LCH3COOH与0.1mol/LNaOH溶液 |
| D、pH=3的醋酸跟pH=11的氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
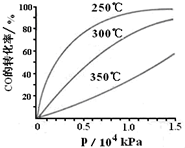 科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:
科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu、Fe3+ |
| B、Fe2+、Fe3+ |
| C、Cu2+、Fe |
| D、Cu,Fe2+,Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com