
| A. | NH4+ | B. | CCl4 | C. | SiH4 | D. | H3P |
分析 分子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数-配原子个数×配原子形成稳定结构需要的电子数),阳离子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数-电荷数-配原子个数×配原子形成稳定结构需要的电子数),阴离子中孤电子对个数=$\frac{1}{2}$(中心原子价电子数+电荷数-配原子个数×配原子形成稳定结构需要的电子数),以此解答.
解答 解:A.铵根离子中孤电子对个数=$\frac{1}{2}$(5-1-4×1)=0,没有孤对电子,故A不选;
B.CCl4中心原子孤电子对个数=$\frac{1}{2}$(4-4×1)=0,没有孤对电子,故B不选;
C.SiH4中孤电子对个数=$\frac{1}{2}$(4-4×1)=0,没有孤对电子,故C不选;
D.PH3中孤电子对个数=$\frac{1}{2}$(5-3×1)=1,故D选.
故选D.
点评 本题考查了化合物中孤电子对个数的计算方法,根据价层电子对互斥理论计算即可,注意其阴阳离子孤电子对个数的计算方法,为易错点,该考点常常与分子的空间构型、原子的杂化方式联合考查,题目难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  表示 KNO3 的溶解度曲线,图中 a 点表示的溶液通过升温可以得到 b 点 | |
| B. |  表示某一放热反应,若使用催化剂 E1、E2、△H 都会发生改变 | |
| C. | 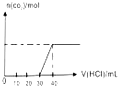 表示向 Na2CO3 和 NaHCO3 的混合溶液中滴加稀盐酸时,产生 CO2 的情况 | |
| D. | 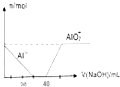 表示向 100mL0.1mol/L 的 AlCl3 和 0.1mol/L 的 NH4Cl 混合溶液中滴加 1mol/L 的 NaOH 溶液时 n(Al3+) 和 n(AlO2-)的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 具有固定熔点或沸点的物质一定是纯净物 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 共价化合物溶于水电离过程中,共价键被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素是典型的非金属元素,因此不能与其他非属元素化合 | |
| B. | 同周期中卤族元素的电负性最小 | |
| C. | 卤素各单质都能和水剧烈反应 | |
| D. | 卤素单质都能和H2反应,且气态氢化物的稳性随单质氧化性的增强而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑥ | C. | ②③⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热煮沸的方法可除去KNO3溶液中混有的Fe3+ | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
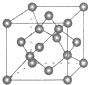 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com