
设NA为阿伏加德罗常数,下列叙述正确的是
A.1mol?L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A、温度相同、体积相同的O2(g)和N2(g)分子数相同
B、等温等压下,SO2气体与CO2气体的密度之比等于16∶11
C、温度和容积相同的两气罐中分别盛有5mol O2(g)和2 mol N2(g),两容积中的压强之比等于5∶2
D、等温等压条件下, 5 molO2(g)和2 molH2 (g)的体积之比等于5∶2
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:填空题
(16分)甲醇是一种可再生燃料。在容积为2L的密闭容 器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。

(1)该反应的△H 0 (填>、<或=)
(2)300℃时,0-t1 min内 CH3OH的平均生成速率为
(3)若要提高甲醇的产率,可采取的措施有_______ 。(填字母)
A 缩小容器体积B 降低温度
C 升高温度 D 使用合适的催化剂
E.甲醇从混合体系中分离出来
(4)300℃时,CO、H2的起始物质的量分别为2mol和3mol,若图中n1数据为0.5mol,试计算300℃下,该反应的平衡常数(写出计算过程,保留两位有效数字)
(5)工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值。下列说法正确的是(用到的相对原子质量:H 1 O16 Al27)
A.18g 2H2O含有10NA个电子
B.1mol苯含有6NA个C-H键
C.常温常压下,22. 4L NH3约含有NA个NH3分子
D.27 g铝片投入足量浓H2SO4中生成1.5NA个SO2分子
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:填空题
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)_____v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K=______ _____;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期第一次质量检测化学试卷(解析版) 题型:实验题
氨气是一种化工原料。
(1)请写出工业上合成氨的化学方程式:
(2)实验室中,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
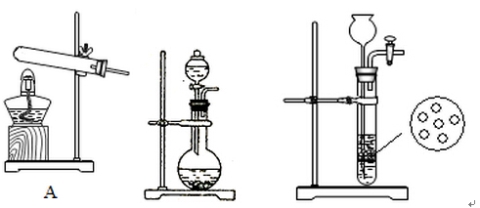
B C
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A
|
| 反应的化学方程式为 ① |
乙小组 |
| 浓氨水、氢氧化钠固体 | 氢氧化钠的作用:氨水中存在平衡: |
(3)请设计一个操作简单的实验,验证NH3·H2O是弱电解质。
。
(4)甲同学把制得的氨气溶于适量水中,得到稀氨水,用标准浓度的盐酸滴定,测定其浓度。实验步骤:准确量取10.00mL稀氨水于锥形瓶中,加入20mL水稀释,滴加 溶液作为指示剂(填“石蕊”、“酚酞”或“甲基橙”),将 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1盐酸装入50ml酸式滴定管,滴定至 ,停止滴定,记录数据。重复滴定2次。平均消耗盐酸Vml。计算原稀氨水的物质的量浓度
= (只列出算式,不做运算)
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
运用相关化学知识进行判断,下列结论错误的是
A.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.需要加热的反应不一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:填空题
(12分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_____ _____;
(2)写出与H2O分子互为等电子体的微粒__ ________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_ ____
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__ ___(请用相应的编号填写)
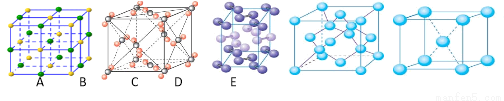
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:选择题
关于能源,以下说法中不正确的是( )
A.煤、石油、天然气等燃料属不可再生能源
B.煤、石油、水煤气可从自然界直接获取,属一级能源
C.太阳能是一级能源、新能源、可再生能源
D.潮汐能来源于月球引力做功
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com