
| A. | 海水中获取溴和碘 | B. | 海水中提取镁 | ||
| C. | 用汽油除去衣服上的油渍 | D. | 用少量食醋除去水壶中的水垢 |
分析 物理变化没有新物质生成,化学变化有新物质生成,常表现为生成气体,颜色改变,生成沉淀等,而且伴随能量变化,常表现为吸热、放热、发光等.
解答 解:A.海水中获取溴和碘,是溴离子等被氧化为单质,涉及化学变化,故A不选;
B.海水中镁的存在形式是镁离子,从海水中提取镁,涉及化学变化,故B不选;
C.用汽油除去衣服上的油渍,利用的是油渍更易溶于汽油,属于物理变化,故C选;
D.食醋除去水垢,利用的是醋酸的酸性强于碳酸,涉及化学变化,故D不选,
故选C.
点评 化学变化是指在原子核不变的情况下,有新物质生成的变化,物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别在于是否有新物质生成.


科目:高中化学 来源: 题型:选择题
| A. | 单位时间内2amol A生成,同时生成3amol B | |
| B. | A、B、C的浓度不再变化 | |
| C. | 混合气体的总压强不再变化 | |
| D. | A、B、C的分子数目比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
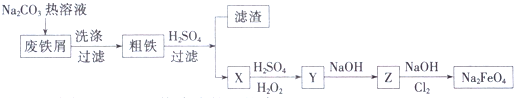
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | SO2通入碘水中,反应的离子方程式为:SO2+I2+2H2O═SO32-+2I-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
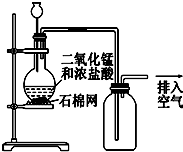
| A. | 该装置图中至少存在三处明显错误 | |
| B. | 该实验中收集氯气的方法不正确 | |
| C. | 如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 | |
| D. | 含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
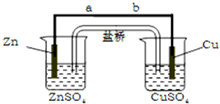
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物通常为O2,对环境没有污染 | |
| B. | 王水是浓硫酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt | |
| C. | 氨水显弱碱性,浓度越大密度越大 | |
| D. | 新制备的氯水中存在三种分子,四种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
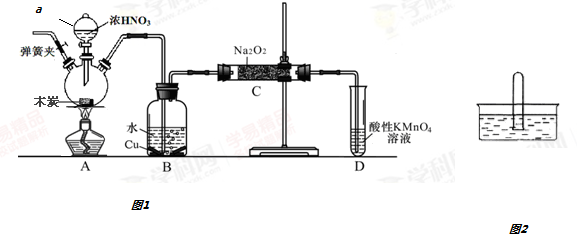
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com