
(15分)
工业上生产氯气,常在电解槽中电解饱和食盐水.
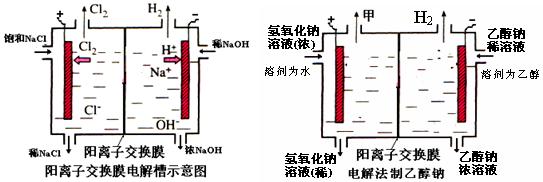
(1)写出该反应的离子方程式 ,电解槽中阳极材料应为 .为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图。
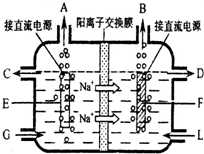
(2)这种阳离子交换膜,只允许溶液中的 通过;(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
写出在电解过程中发生的电极方程式:阳极: ;
(3)若不用阳离子交换膜,电解产物之间发生的主要反应方程式为 。
(4)已知某电解槽每小时加入10%的氢氧化钠溶液l0kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 ;
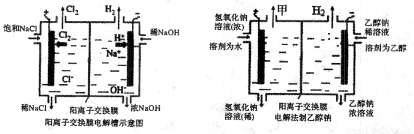
(5)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.
回答下列问题:
①写出在电解过程中发生的电极方程式:阴极: .
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.2- 4 |
| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
2- 4 |
| ||
| ||
| ||
ρV1-
|
| ||
ρV1-
|
查看答案和解析>>
科目:高中化学 来源:09—10年扬州中学高一下学期期末考试化学卷 题型:填空题
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)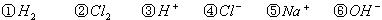
⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
查看答案和解析>>
科目:高中化学 来源:09-10年扬州中学高一下学期期末考试化学卷 题型:填空题
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)

⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。
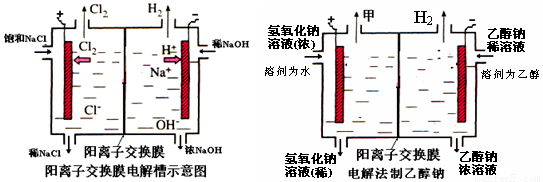
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com