
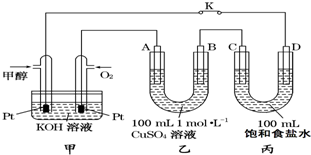
 如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.分析 (1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,注意电解质溶液是碱性溶液;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气;A电极为阳极,溶液中的氢氧根离子失电子生成氧气;阳极电极反应和电子守恒计算得到;
(3)C极与正极相连为阳极,Cu在阳极失电子生成铜离子,根据转移电子守恒计算;D极为阴极,阴极上水得电子生成氢气和氢氧根离子.
解答 解:(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为x,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L,
故答案为:4OH--4e-=2H2O+O2↑;2.24L;
(3)C极与正极相连为阳极,Cu在阳极失电子生成铜离子,甲电池中消耗0.1mol氧气,转移电子为0.4mol,则丙中也转移0.4mol电子,由Cu-2e-=Cu2+可知参加反应的Cu为0.2mol,器质量为12.8g,即C极的质量变化为;D极为阴极,阴极上水得电子生成氢气和氢氧根离子,所以滴入酚酞溶液D极附近溶液变红;
故答案为:12.8g;有气泡产生,D极附近溶液变红.
点评 本考查了燃料电池和电解原理的应用,题目难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力,注意把握电极的判断、电极方程式的书写和电子守恒在计算中的应用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
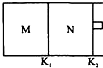 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | 对于有气体参加的反应,增大压强,反应速度加快 | |
| D. | 恒容容器中,在气体反应体系中充入稀有气体,化学反应速率不发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同位素的两种原子 | B. | 两种不同元素的原子 | ||
| C. | 一种原子和一种离子 | D. | 一种阴离子和一种阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 若溶液中部分粒子间满足:c(CH3COO-)=c(Na+),则该溶液一定呈中性 | |
| C. | 若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间可能满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| B. | 常温常压下,1 mol HD含有中子总数为2NA | |
| C. | 常温常压下,32 g O2中含有的分子数为NA | |
| D. | 100 mL 1 mol•L-1K2SO4溶液中含有的钾离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.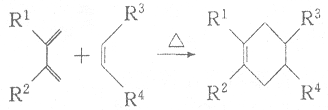
 .
.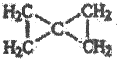 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com