
分析 (1)NaCN易与酸发生反应生成HCN,而HCN有剧毒,故应该使溶液的pH呈碱性;NaCN与NaClO反应生成NaOCN和NaCl,根据反应方程式计算;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,结合氧化还原反应中化合价升降相等配平;
(3)参加反应的NaCN为$\frac{100×(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,利用电子守恒计算.
解答 解:(1)NaCN易与酸反应生成HCN,为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性;NaCN与NaClO反应生成NaOCN和NaCl,其反应方程式为:NaCN+NaClO=NaOCN+NaCl,所以欲使1molNaCN变为NaOCN,则需要氧化剂NaClO为1mol;
故答案为:碱性;防止生成HCN,造成人员中毒或污染空气;1;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑,
故答案为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;
(3)参加反应的NaCN是:$\frac{100×(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:$\frac{20mol×5}{2}$×74.5g/mol×4=1490g,
故答案为:1490.
点评 本题考查了氧化还原反应方程式书写、计算等,题目难度中等,明确氧化还原反应的实质及配平原则为解答关键,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
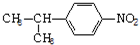
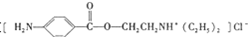 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: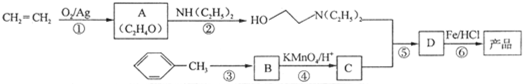
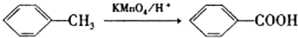
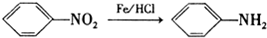
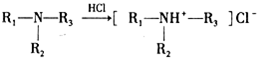
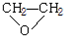 .
.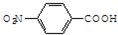 ,C中含有的含氧官能团的名称为硝基和羧基.
,C中含有的含氧官能团的名称为硝基和羧基.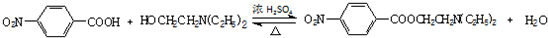 .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、HCO3- | D. | Al3+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3gNa在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6 L NH3中含有的氢原子数目为0.75NA | |
| C. | 1L0.1mol/LH3PO4溶液中含有的离子数目为0.4NA | |
| D. | 1个C02分子的质量为$\frac{44}{N_A}g$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
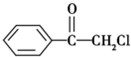 (1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)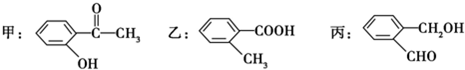
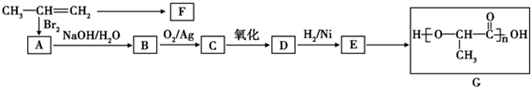
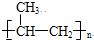 ;
; ;
;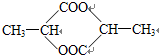 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
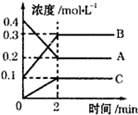 如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题:
如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题: 2B+C.
2B+C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
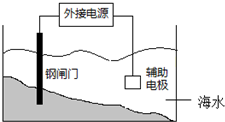
| A. | 钢闸门应与外接电源的负极相连 | |
| B. | 该装置的原理是“牺牲阳极阴极保护法” | |
| C. | 辅助电极材料可用锌 | |
| D. | 阴极的电极反应式:2Cl--2e→Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提纯含有少量溴的溴苯:向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,静置、分液,并除去有机相的水 | |
| D. | 比较AgCl、AgI的Ksp:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com