
| A. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-)>c(Na+)>c(HR-) | |
| B. | 将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| C. | 某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a | |
| D. | 相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1 |
分析 A.酸是弱酸,碱是强碱,混合溶液呈中性,说明反应中酸稍微过量,结合电荷守恒判断;
B.酸和碱混合后,溶液中存在物质的量浓度都是0.05mol/L的NaA和HA,根据物料守恒和电荷守恒判断;
C.某溶液中水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,说明该物质抑制水电离,则该物质的水溶液呈酸性或碱性;
D.相同温度下的醋酸溶液中,醋酸浓度越大,醋酸的电离程度越小.
解答 解:A.该溶液共含有5种离子:Na+、H+、R2-、HR-、OH-,根据电荷守恒可知:2c(R2-)+c(OH-)+c(HR-)=c(H+)+c(Na+),由于溶液为中性,则c(OH-)=c(H+),故2c(R2-)+c(HR-)=c(Na+),所以反应后的溶液中浓度最大的是Na+,故A错误;
B.酸和碱混合后,溶液中存在物质的量浓度都是0.05mol/L的NaA和HA,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得2c(Na+)=c(A-)+c(HA),所以得2c(OH-)+c(A-)=2c(H+)+c(HA),故B正确;
C.某溶液中水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,说明该物质抑制水电离,则该物质的水溶液呈酸性或碱性,如果溶液呈酸性,溶液中c(OH-)=c(H+)(水电离的)=1×10-amol/L,则溶液的pH=14-a,如果溶液呈碱性,溶液中氢离子浓度就是水电离出的氢离子浓度,则溶液的pH=a,故C正确;
D.醋酸是弱电解质,相同温度下,醋酸的浓度越大其电离程度越小,所以0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1,故D正确;
故选A.
点评 本题考查离子浓度大小比较及酸碱混合溶液的定性判断,题目难度中等,根据电荷守恒和物料守恒来分析解答,注意相同温度下,弱电解质的浓度与电离程度的关系,为易错点.


科目:高中化学 来源: 题型:解答题
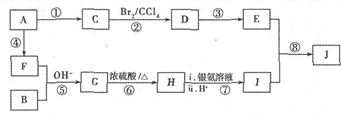
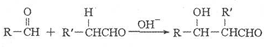
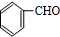 ,它的分子中含有4种不同化学环境的氢原子.
,它的分子中含有4种不同化学环境的氢原子.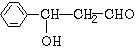 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$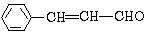 +H2O.
+H2O.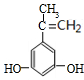 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,能干燥氢气,也能干燥氨气 | |
| B. | 乙醛具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化 | |
| C. | SO2具有漂白性,能使品红褪色,也能使酸性KMnO4溶液褪色 | |
| D. | 硝酸属于强酸,能与CaCO3反应生成CO2气体,也能与CaSO3生成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 还原性:HCl、HBr、HI | ||
| C. | 酸性:HClO4、H2SO4、H3PO4 | D. | 稳定性:HI、HBr、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
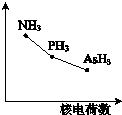 氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )| A. | 稳定性 | B. | 沸点 | C. | R-H键长 | D. | 分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量二氧化硫与苛性钠溶液反应:SO2+2OH-=SO32-+H2O | |
| B. | 过量稀盐酸加入纯碱中:CO32-+2H+=H2O+CO2↑ | |
| C. | 铜粉与稀硫酸溶液反应:Cu+2H+=Cu2++H2↑ | |
| D. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
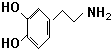
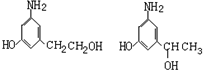 .
.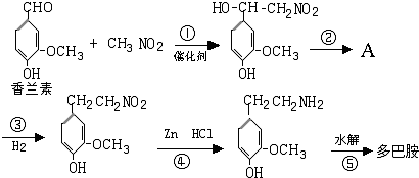
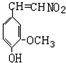 .
.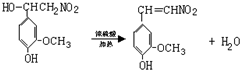 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com