
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
分析 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据电子注意计算金属总物质的量,金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
B.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属);
C.n(NaOH)=n(OH-),根据V=$\frac{n}{c}$计算加入的氢氧溶液的体积;
D.根据电子转移守恒计算n(NO),然后计算出标况下一氧化氮的体积.
解答 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据反应方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,镁和铜的总的物质的量为铜离子物质的量的一半,即:$\frac{0.3mol}{2}$=0.15mol,假定全为镁,金属质量为0.15mol×24g/mol=3.6g,若全为铜,金属质量为:0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量不可能为3.0g,故A错误;
B.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属)=$\frac{8}{3}$×0.15mol=0.4mol,故B错误;
C.反应消耗氢氧化钠的物质的量为:n(NaOH)=n(OH-)=0.3mol,则加入的氢氧化钠溶液的体积为:V=$\frac{0.3mol}{3mol/L}$=0.1L=100mL,故C正确;
D.金属的物质的量为0.15mol,完全反应失去0.15mol×2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量为:n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,在标准状况下0.1molNO的体积为2.24L,故D错误;
故选C.
点评 本题主要考查混合物有关计算,涉及镁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度中等.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:解答题
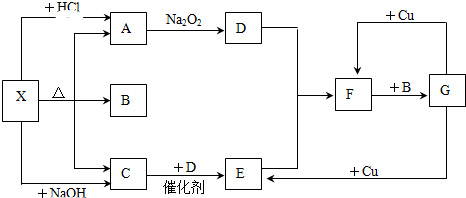
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
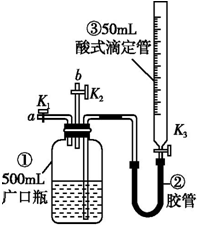 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
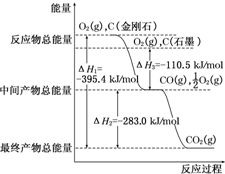 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:解答题
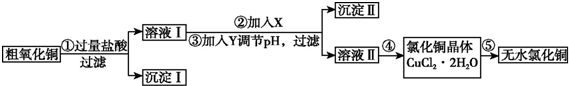
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
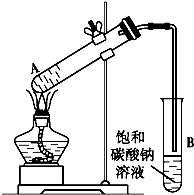 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
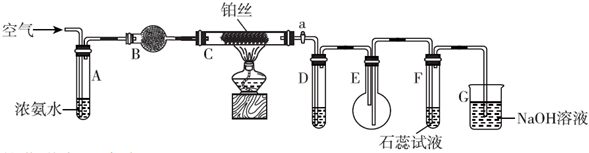
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
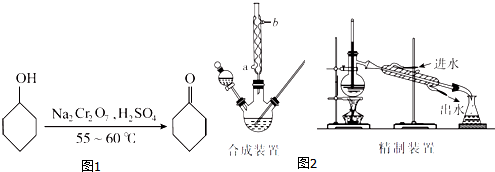
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
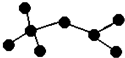 如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com