
| A. | ③④ | B. | ③⑤ | C. | ②③⑤ | D. | ②④ |
分析 混合物是由多种物质组成的物质;
化合物是由不同种元素组成的纯净物;
在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
在水溶液里和熔融状态下都不能导电的化合物是非电解质,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
质子数相同,中子数不同的核素互称为同位素.
解答 解:①波尔多液、盐酸属于混合物,水银是金属单质,故错误;
②氯化钾、甲烷属于化合物,HD属于单质,故错误;
③明矾、胆矾、硫酸钡都是电解质,故正确;
④酒精、CO2属于非电解质,Cl2 属于单质,既不是电解质,也不是非电解质,故错误;
⑤12C、13C、14C.质子数都是6,中子数不同分别是6,7,8,互为同位素,故正确;
故选:B.
点评 本题考查化合物、混合物、电解质、非电解质和同位素,明确物质的成分和相关的定义是解题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
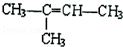 的名称是2-甲基-2-丁烯
的名称是2-甲基-2-丁烯 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Cl-、HCO3-、SO42- | |
| B. | pH=12的澄清的溶液中:K+、Na+、MnO4-、SO42- | |
| C. | 甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- | |
| D. | 加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、CO32-、NO3- | B. | Ca2+、CO32-、Na+、NO3- | ||
| C. | Na+、H+、NO3-、CO32- | D. | K+、Fe3+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用风能发电、采取节能技术、使用太阳能热水器均有利于减少二氧化碳排放 | |
| B. | 生活垃圾焚烧发电也会产生有毒有害物质 | |
| C. | 丁达尔现象可用于区别溶液与胶体,云、雾、淀粉溶液均能产生丁达尔现象 | |
| D. | 硅酸钠溶液的保存和碱溶液一样,存放在橡胶塞密封的广口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将总物质的量为4mol的Na2O2和Al2(SO4)3混合物投入足量水中,充分反应后生成ymol沉淀(y≠0).若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值与y=f(x)关系式填写在表内(可填满,也可不填满或补充),并在图中画出函数图象.
将总物质的量为4mol的Na2O2和Al2(SO4)3混合物投入足量水中,充分反应后生成ymol沉淀(y≠0).若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值与y=f(x)关系式填写在表内(可填满,也可不填满或补充),并在图中画出函数图象.| x值 | y=f(x) |
| 0<x≤3 | y=$\frac{2}{3}$x |
| 3<x<3.2 | y=32-10x |
| - | - |
| - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L的CO气体与l mol N2所含的电子数为14 NA | |
| B. | 物质的量浓度为0.5 mol/L Mg Cl2溶液,含有Cl-数为NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2 NA | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移电子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| ①ClO2 | ②浓氨水 | ③SO2 | ④浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com