
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤⑥ | D. | ③④⑥ |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
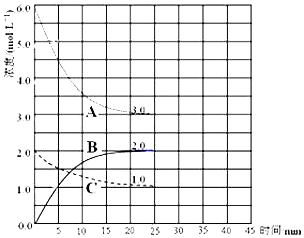

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙烷在氧气中燃烧;乙烯在氧气中燃烧 | |
| C. | 乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色 | |
| D. | 工业上由乙烯和水反应生成乙醇;乙烯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放NaOH溶液的试剂瓶用磨口玻璃塞 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 过氧化钠保存在广口瓶中 | |
| D. | 浓盐酸保存在细口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
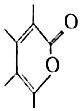 以下说法正确的是( )
以下说法正确的是( )| A. | 一Me基团的电子式为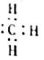 | |
| B. | 该合成过程的反应类型属于加成反应 | |
| C. | 产物与 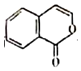 互为同分异构体 互为同分异构体 | |
| D. | 产物可与H2发生加成反应,反应的物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
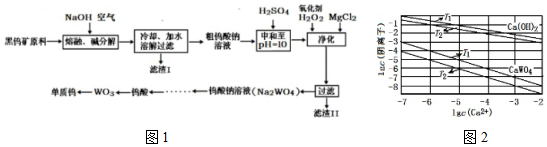
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
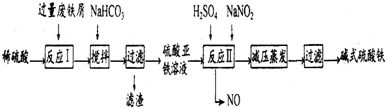
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com