
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图。
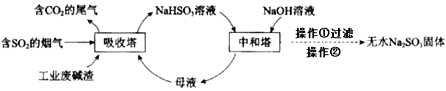
下列说法中不正确的是
A.吸收塔中的温度不宜过高,原因可能是防止SO2的溶解度下降
B.为提高NaHSO3的产率,应控制吸收塔中溶液为弱碱性
C.吸收塔中生成HSO3-的离子方程式是2SO2+CO32-+H2O=2HSO3-+CO2↑
D.操作②为蒸馏水洗涤、干燥,得无水Na2SO3固体
科目:高中化学 来源: 题型:
【题目】丙烯是仅次于乙烯的有机化工原料,可由丙烷脱氢氧化制取。丙烷脱氢氧化工艺包含的反应有:
主反应:①C3H8(g)![]() C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
②H2(g)+![]() O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
副反应:③C3H8(g)![]() CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
④C2H4(g)+H2(g)![]() C2H6(g) △H4=-136.94 kJ·mol-1
C2H6(g) △H4=-136.94 kJ·mol-1
⑤C3H8(g)+H2(g)![]() CH4(g)+C2H6(g) △H5
CH4(g)+C2H6(g) △H5
回答下列问题:
(1)△H5=____kJ·mol-1。
(2)图1是制备工艺中一些反应平衡常数的对数值与温度的关系图,欲提高丙烯的产率,能否尽可能的提高反应温度?_________,其原因是__________________。除温度外,下列还可提高丙烯产率的措施有_________(填序号)

A 降低压强 B 增大压强
C 采用选择性优良的催化剂 D 选择性的氧化消除部分氢气
(3)实际脱氢工艺中常常通入水蒸汽,以改变丙烷的平衡转化率。图2为常压、600~1000K时,不同水烃比M下丙烷脱氢反应的平衡转化率变化图。由图可知,常压、温度恒定时水烃比对平衡转化率的影响规律为____________。设某温度、1 atm(记为p0)下丙烷的脱氢转化率为y,加入反应体系的水蒸汽与原料丙烷的物质的量之比为M,则脱氢反应的平衡常数Kp=____(Kp为以分压表示的平衡常数,写出表达式即可)。
(4)当反应温度为923K时,计算可知脱氢反应的反应热为+115.66 kJ·mol-1,烧氢反应的反应热为-237.75 kJ·mol-1,为保证烧氢所放热量完全满足脱氢吸热之用(假设脱氢率为100%),则烧氢率应大于_____;由此可见,烧氢过程不仅可以提高丙烷脱氢的转化率,还可以_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1) 当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=________________________;
(2) 当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b=_________,得到的CO和CO2的物质的量之比n(CO):n(CO2)=______________。
(3) a的取值范围是____________________;b的取值范围是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
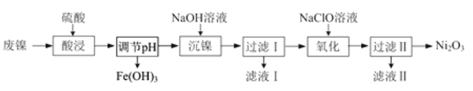
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有_____________(任写出一条)。
(2)“酸浸”时Fe2O3发生反应的离子方程式:____________________________________。
(3)“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于__________ [已知Fe(OH)3的Ksp=4×10-38,![]() ≈1.6 ]。
≈1.6 ]。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是_____________________________________。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:____________________。
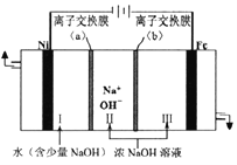
(6)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的![]() 。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)从下列物质中选择对应类型的物质的序号填空。
① CH3OCH3 ② HCOOCH2CH3③CH3COCH3④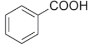 ⑤CH3CHO ⑥
⑤CH3CHO ⑥![]() ⑦
⑦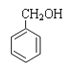
A. 属于羧酸的是________; (填序号,下同) B. 属于酯的是________;
C. 属于醇的是__________; D. 属于酮的是________。
(2)下列各组物质:
① O2和O3;②乙醇和甲醚;③ 淀粉和纤维素;④ 苯和甲苯;⑤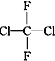 和
和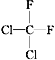 ;⑥
;⑥ 和
和![]() ;⑦ CH3CH2NO2和
;⑦ CH3CH2NO2和![]()
A.互为同系物的是_________;(填序号,下同) B.互为同分异构体的是________;
C.属于同一种物质的是__________; D. 互为同素异形体的是________。
(3)为了测定芳香烃A的结构,做如下实验:
①将9.2g该芳香烃A完全燃烧,生成标况下15.68L CO2和7.2gH2O;
②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是________,有机物A的分子式为_________。
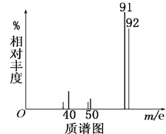
③用核磁共振仪处理该有机物得到四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系。下列说法错误的是
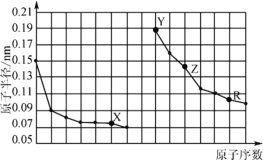
A.X、R的最高化合价相同
B.电解熔融的X与Z构成的化合物可以得到单质Z
C.X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1
D.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。
完成下列填空:
(1)实验室配制氯化铝溶液时加入盐酸的目的是______________________________________________。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是________(选填编号)。
a.Na2CO3 b.NaOH c.NaAlO2 d.H2SO4
(3)用滴管向试管中滴加少量AlCl3溶液时,滴管不得伸入试管中的理由是__________________,用试管夹夹持上述试管在酒精灯上加热时,不断上下移动试管的目的是____________________________。取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体为________。
(4)为确定Al2(OH)nCl(6-n)中n的值,取3.490 g白色固体,全部溶解在0.112 0 mol的HNO3(足量)中,并加水稀释成100 mL,将溶液分成两等份,进行如下实验:
①一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020 g,判断加入氨水已足量的操作是________。过滤、洗涤后至少要灼烧________次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因可能是________(选填编号)。
a.干燥Al(OH)3固体时易失水
b.Al2O3的质量比Al(OH)3大,误差小
c.沉淀Al(OH)3时不完全
d.灼烧氧化铝时不分解
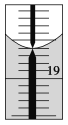
②从另一份溶液中取出20.00 mL,用0.129 0 mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00 mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数________ mL,Al2(OH)nCl(6-n)中n的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B. Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com