

| A. | 充电时电极b连接电源的正极 | |
| B. | 放电时右侧电解质储罐中的离子总浓度增大 | |
| C. | 放电时电极a连接粗铜可实现粗铜的精炼 | |
| D. | 充电时阴极反应式为2H++2e-=H2↑ |
分析 放电时,Zn是负极,负极反应式为:Zn-2e-═Zn2+,正极反应式为:Br2+2e-=2Br-,充电时,阳极反应式为2Br--2e-=Br2、阴极反应式为Zn2++2e-=Zn,放电时,只有阳离子能穿过交换膜,阴离子不能穿过交换膜,据此分析解答.
解答 解:放电时,Zn是负极,负极反应式为Zn-2e-═Zn2+,正极反应式为Br2+2e-=2Br-,充电时,阳极反应式为 2Br--2e-=Br2、阴极反应式为Zn2++2e-=Zn,
A.充电时,a是阳极,应该连接电源正极,b为负极,与电源负极相连,故A错误;
B.放电时,负极反应式为Zn-2e-═Zn2+,阳离子能穿过交换膜,则右侧电解质储罐中离子总浓度基本不变,故B错误;
C.放电时,a为电源正极,则电极a连接粗铜可实现粗铜的精炼,故C正确;
D.充电时,阳极反应式为 2Br--2e-=Br2、阴极反应式为Zn2++2e-=Zn,故D错误;
故选C.
点评 本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.


科目:高中化学 来源: 题型:选择题
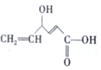 ,下列关于X的说法正确的是( )
,下列关于X的说法正确的是( )| A. | X中有4种官能团 | |
| B. | X的分子式为C6H5O3 | |
| C. | X可发生氧化、取代、加成反应 | |
| D. | 1molX与足量钠反应可生成11.2L气体(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Br>Ga>Cl>Al | |
| B. | 碱性:Ga(OH)3>Al(OH)3 酸性:HClO4>HBrO4 | |
| C. | 7935Br与8135Br得电子能力不同 | |
| D. | 与镓同周期且相邻的主族元素,其原子序数为30或32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羰基硫是电解质 | B. | 羰基硫分子的电子式为: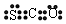 | ||
| C. | C、O、S三个原子中半径最小的是C | D. | 羰基硫分子为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | W(g) | X(g) | Y(g) | Z(g) |
| 初始浓度(mol/L) | 4.0 | 2.0 | 0 | 0 |
| 2min末浓度(mol/L) | 2.4 | 1.2 | 0.8 | 1.6 |
| A. | 2min内X的平均速率为0.6mol/(L•min) | |
| B. | 该反应的化学方程式可表示为:2W(g)+X(g)?2Y+Z | |
| C. | 若达到平衡后保持压强不变充入Ne,平衡不移动 | |
| D. | 平衡后再加入W,则W的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.05mol/(L•min) | B. | v(N2)=0.03mol/(L•min) | ||
| C. | v(NH3)=0.17g/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾的燃烧实验需用到的实验仪器除镊子、坩埚外,还需 2 种仪器即:三脚架和酒精灯 | |
| B. | 向盛 Na2SiO3 溶液的试管中滴加 1 滴酚酞,然后逐滴加入稀盐酸至红色褪去2 min后,试管里出现凝胶,则说明非金属性:Cl>Si | |
| C. | 金属性 K>Na,则钾可将 NaCl 溶液中的 Na 置换出来 | |
| D. | 欲鉴别乙烯和乙烷,可将二者分别通入高锰酸钾酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟乙酸甲酯仅含有一种官能团 | |
| B. | 氟乙酸甲酯的同分异构体属于羧酸类的有3种 | |
| C. | lmol氟乙酸甲酯与NaOH水溶液共热最多消耗2molNaOH | |
| D. | 氟乙酸甲酯加入稀硫酸共热后生成的有机物是HOCH2COOH和CH3OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com