
| A. | CH5+、-OH、NH3各1mol,所含的电子数均为10NA | |
| B. | 20℃、101kPa条件下,11.2L丁烷中含极性共价键的数目大于5NA | |
| C. | 78gNa2O2和Na2S的固体混合物中含有的阴离子数目一定是NA | |
| D. | 0.1mol•L-1AlCl3溶液中含有Al3+的数目一定小于0.1NA |
分析 A、-OH中含9个电子;
B、20℃、101kPa条件下,气体摩尔体积大于22.4L/mol;
C、Na2O2和Na2S的摩尔质量均为78g/mol,且均由2个阳离子和1个阴离子构成;
D、溶液体积不明确.
解答 解:A、-OH中含9个电子,故1mol-OH中含9NA个电子,故A错误;
B、20℃、101kPa条件下,气体摩尔体积大于22.4L/mol,故11.2L丁烷的物质的量小于0.5mol,则含有的极性共价键小于5NA条,故B错误;
C、Na2O2和Na2S的摩尔质量均为78g/mol,故78g混合物的物质的量为1mol,且两者均由2个阳离子和1个阴离子构成,故1mol混合物中含有的阴离子为NA个,故C正确;
D、溶液体积不明确,故溶液中的铝离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | H2O和D2O | ||
| C. | O2与O3 | D. | CH3OCH3与CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNaHSO4固体中所含阴阳离子数目总数为3NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 27g铝与lmol/L的盐酸充分反应,转移电子数目为3NA | |
| D. | 标准状况下,44.8升NO与22.4升O2完全反应所得分子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用含微量NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F以防止蛀牙,则一般可说明后者的Ksp小于前者的Ksp | |
| B. | 室温下向苯和含少量苯酚杂质的混合溶液中加入适量浓溴水,振荡,静置后过滤,可除去苯中少量苯酚杂质 | |
| C. | 用1.00mol/L 标准盐酸滴定未知浓度的NaOH溶液10.00mL,滴定前将25.00mL 酸式滴定管中盐酸调至“0”刻度,将盐酸滴完恰好滴定至终点,则可得c(NaOH)=2.50mol/L | |
| D. | 向4ml 2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL 有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液的pH | |
| B. | 将 4 mL 0.0lmol•L-1 KSCN溶液与1 mL 0.01 mol•L-1 FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡Fe3++3SCN-?Fe(SCN)3 | |
| C. | 测定中和反应的反应热时,将碱的稀溶液缓慢倒入一定量的稀醋酸溶液中,所测反应后混合液温度值偏小 | |
| D. | 测定NaaSO4溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 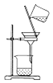 用装置分离Fe(OH)3胶体和NaCl溶液 | |
| B. | 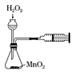 用装置定量测定H2O2的分解速率 | |
| C. |  用装置将CuSO4•5H2O变无水CuSO4 | |
| D. | 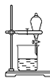 用装置④分离饱和Na2CO3溶液和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属 Na 暴露在空气中,光亮表面逐渐变暗2Na+O2═Na 2O2 | |
| B. | 向 AgCl 悬浊液中滴加 Na2S 溶液,白色沉淀变成黑色2AgCl+S2-═Ag2S↓+2Cl- | |
| C. | Na 2O2 在潮湿空气中放置一段时间,变成白色黏稠物2Na 2O2+2CO2═2Na 2CO3+O2 | |
| D. | 向 NaHCO3 溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca 2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com