
【题目】根据氧化还原反应Zn+2H+=Zn2++H2↑设计一个原电池?并判断正负极、写出各电极电极反应方程和反应的类型(在方框内画出原电池装置图) 负极:
正极:
负极反应:
正极反应:
负极反应类型:
正极反应类型:
原电池装置图: .
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A. H2SO4===H2++SO42- B. Ba(OH)2===Ba2++OH﹣
C. NaNO3===Na++NO3- D. CuSO4===Cu+2+SO4-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2 c1>c3 B. a + b=92.4 C. 2P1<P3 D. α1 +α3=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是

A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
D. 当b极有0.001 mol Fe3+被还原时,则通过盐桥的电子数为0.001 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元索W、X、Y、Z的原子序数依次增加。Z单质是常见的黄绿色气体,u是Y的最高价氧化物且具有两性,v是X的最高价氧化物对应的水化物。常温下,0.01mol·L-1 v溶液的pH为12,0.01 mol·L-1 r溶液的pH为2,上述物质的转化关系如图所示。下列说法正确的是
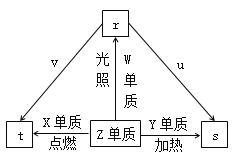
A. 单质沸点:W>Z
B. 原子半径:X>Z>W
C. Y、Z形成的化合物中化学键的类型是离子键
D. X的简单离子比Y的简单离子氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
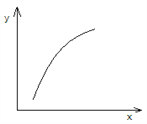
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三个图是某研究小组利用过氧化氢酶探究H2O2分解条件而获得的实验结果。请回答下列有关问题:
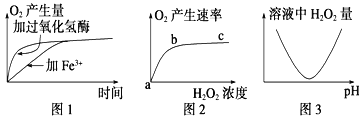
(1)图1、2、3所代表的实验中,实验自变量依次为 、H2O2浓度、pH。
(2)根据图1可以得出的实验结论是 。
(3)图2曲线bc段产生的最可能原因是 。
(4)若进行图2所代表的实验时增加过氧化氢酶的含量,请在图2中,利用虚线绘出曲线的变化情况。
(5)能否以H2O2为材料来探究温度对H2O2酶活性的影响?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com