
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了NazS04中的一个O原子而
形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学
性质。
【提出问题】Na2S2O3是否与Na2S2O4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想①②,设计实验方案。
| 实验操作过程 | 实验现象或 预期实验现象 | 现象解释 (用离子方程式表示) | |
|
▲ |
溶液pH=8 |
| |
| 猜想① | 向Ph=2的硫酸中滴加 Na2S2O3溶液 | ▲ |
|
| 猜想② | 向新制氯水(pH<2)中滴 加少量Na2S2O3溶液 | 氯水颜色变浅 | ▲ |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2S2O4的化学性质不相似。
【问题讨论】
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀并
据此认为氯水可将Na2S2O3氧化。你认为该方案是否合理并说明理由 ▲ 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3。被氯水氧化 ▲ 。
实验操作:把Na2S2O3溶于水,配成一定浓度溶液,把pH试纸置于干净的玻片,用玻璃棒蘸取溶液至pH试纸上,与标准比色卡对照,读出pH值
实验现象:有刺激性气味的气体生成,同时溶液中有淡黄色固体沉淀
离子方程式:S2O32—+ 4Cl2+5H2O=8 Cl—+ 2 SO42—+10H+
(1) 不合理,因为氯水过量,氯水中含有Cl—,无法证明AgCl沉淀中的Cl—来源
(2) 取少量反应后溶液,加入BaCl2溶液,若有白色沉淀,则说明S2O32—被氧化
本题考查验证性化学实验方案的设计以及实验现象、结论的表述。题目较易。基于实验目的,根据实验现象或结论很容易判断实验方案的设计目的及验证哪部分猜想。要求注意问题讨论中的细节,即(1)中猜想②的实验过程中滴加“少量”的Na2S2O3得出甲方案不合理的原因是过量氯水能提供Cl—,与Ag +产生白色沉淀,干扰性质验证,可变换试剂,用钡盐检测氧化产物SO42—。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2014届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:实验题
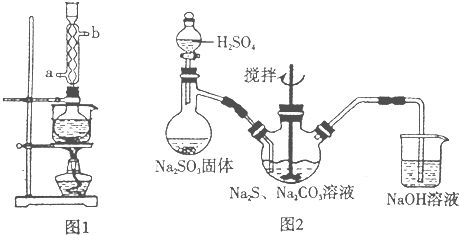
硫代硫酸钠( Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氧剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
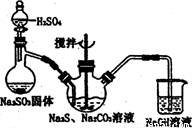
图l 图2
(1)用图l所示装置制取Na2S2O3,其中NaOH溶液的作用是: 。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。
为测定所得保硷粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2 Na2S2O3+I2=2NaI+Na2S4O6。
(2)利用KIO3、KI和HCI可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
(3)准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示荆,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
(4)若漓定时振荡不充分,刚看到溶液局部变色就停止漓定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果____(填“偏高”偏低”或“不变”)。
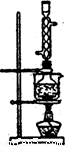
(5)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。
已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通人冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下‘
④ ;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com