
将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
A.反应过程中得到6.72L的气体(标准状况下)
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8g的沉淀
D.最终得到的溶液中c(NaCl)=1.6 mol/L
C
【解析】
试题分析:A、将Na2O2和Al同时放入一定量的水中,发生反应:2Na2O2 + 2 H2O = 4NaOH+O2
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
n( Na2O2 )= 0.2mol n (O2) = 0.1mol V(O2)=2.24L
n(Al)= 0.2mol n (H2) = 0.3mol V(H2)=6.72L 故反应过程中得到的气体V总=8.96L,错误;
B、反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,由电荷守恒知:
c(Na+)=c(Cl-)+c(OH-)+c(AlO2-)-c(H+),错误;
C、根据方程式进行计算得到:将15.6gNa2O2和5.4gAl同时放入一定量的水中后溶液的成分是0.2molNaOH和0.2mol NaAlO2,再通入0.3molHCl气体,反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,生成0.1molAl(OH)3,质量为7.8g,正确。
D、反应后溶液的成分是0.3molNaCl 0.1molNaAlO2,所以c(NaCl)= 0.3mol/0.2L=1.5 mo/L,错误。
考点:Na2O2和Al与水的反应,在化学选择题中电荷守恒法的应用,元素守恒法的应用。


科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:填空题
(9分)下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
a |
|
| |||||||||||||||
|
|
|
| f |
| h | i |
| |||||||||
| b |
| e |
|
|
| j |
| |||||||||
c |
|
|
|
|
|
|
| d |
|
|
|
| g |
|
| k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| l |
|
(1)请写出d在元素周期表中的位置 ;
(2)请写出上述元素k的核外电子排布式 ;
(3)b、e、j三种元素的电负性由大到小的顺序 (写元素符号);此三种元素的第一电离能由大到小的顺序 (写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水化物与a、c、h三种元素形成的化合物反应的离子方程式 ;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出k、l的互化物的电子式 ,它是由 键形成的 化合物(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g)  2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A.达到平衡时,SO2的浓度与SO3的浓度相等
B.相同状况下,反应2SO3(g)  2SO2(g)+O2(g)是一个吸热反应
2SO2(g)+O2(g)是一个吸热反应
C.为了提高SO2转化率,可适当提高O2浓度
D.升高温度,放热反应的速率增大,吸热反应的速率也增大
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大
B.某溶液中由水电离出的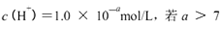 时,则该溶液的pH一定为14-a
时,则该溶液的pH一定为14-a
C. pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液
中: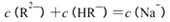
D.相同物质的量浓度的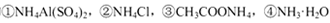 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:计算题
(6分)
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分【解析】
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
⑴试写出Pb2O3与浓盐酸反应的化学方程式__________________________
⑵通过计算确定y与a、x的函数关系式____________________
⑶若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为____;其物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.左、下方区域的金属元素 B.金属元素和非金属元素分界线附近的元素
C.右、上方区域的非金属元素 D.稀有气体元素
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
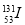 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中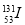 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关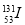 的叙述中错误的是( )
的叙述中错误的是( )
A. 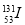 的化学性质与
的化学性质与 相同 B.
相同 B. 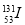 的原子序数为53
的原子序数为53
C. 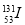 的原子核外电子数为78 D.
的原子核外电子数为78 D. 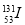 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:填空题
(15分)簸箩酯是一种食用香料,是化合物甲与苯氧乙酸 -O-CH2-COOH发生酯化反应的产物。
-O-CH2-COOH发生酯化反应的产物。
(1)甲一定含有的官能团的名称是_________。
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是______________________。
(3)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)___________ _____________。
(4)已知:

簸箩酯的合成线路如下:
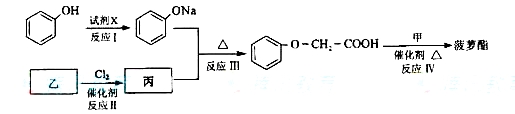
①试剂X不可选用的是(选填字母)__________。
A、CH3COONa溶液 B、NaOH溶液 C、NaHCO3溶液 D、Na
②丙的结构简式是___________,反应Ⅱ的反应类型是_____________________。
③反应Ⅳ的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A.原子核中有6个中子的硼原子:6 B B.HCl的电子式:
C.K+结构示意图: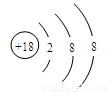 D.HClO的结构式:H—O—Cl
D.HClO的结构式:H—O—Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com