
| A. | K的大小与起始浓度有关 | B. | 温度越高,K值越大 | ||
| C. | K值越大,反应正向进行的程度越大 | D. | K值越大,反应正向进行的程度越小 |
分析 平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,与浓度、压强无关,平衡常数越大,说明可逆反应进行的程度越大,以此解答该题.
解答 解:A.平衡常数是温度的函数,只与温度有关,对于同一个化学反应来说,在相同温度下,平衡常数为定值,故A错误;
B.温度升高,如平衡向正反应方向移动,则K值增大,如向逆反应方向移动,则K值减小,故B错误;
C.K值越大,说明平衡时生成物浓度越大,反应物浓度越小,则反应物的转化率越大,故C正确;
D.K值越大,反应物的转化率越大,则正向反应进行的程度越大,故D错误.
故选C.
点评 本题考查了化学平衡常数、影响因素及应用,为高频考点,侧重于学生的分析能力的考查,难度不大,注意化学平衡常数只与温度有关,同一转化关系化学计量数不同,平衡常数不同,温度相同,同一可逆反应的正、逆反应平衡常数互为倒数.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨 | |
| B. | 雷雨闪电时,大气中产生了一氧化氮 | |
| C. | 豆科作物的根瘤菌将空气中的氮转化为氨 | |
| D. | 在一定条件下由氨气和二氧化碳合成尿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+H+ Ba2+ |
| 阴离子 | OH- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2 溶液 | B. | AgNO3 溶液 | C. | Ba(OH)2 溶液 | D. | NaOH 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA | |
| C. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA | |
| D. | 1 mol/L的盐酸溶液中含的离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
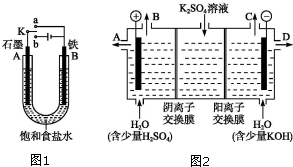 某课外活动小组用如图装置进行实验,试回答下列问题:
某课外活动小组用如图装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的结构类似于金刚石 | |
| B. | 硅是良好的半导体材料 | |
| C. | 硅的性质较稳定,在自然界中存在游离态 | |
| D. | 可以用焦炭还原二氧化硅生成硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com