
分析 平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,互为逆反应的平衡常数互为倒数,化学计量数为倍数关系时平衡常数为平方关系;
解答 解:448℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K1为49,
则温度下反应2HI(g)?H2(g)+I2(g)的平衡常数K2为$\frac{1}{{K}_{1}}$=$\frac{1}{49}$,
反应$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g)的平衡常数K3为$\sqrt{{K}_{1}}$=$\sqrt{49}$=7,
反应2H2(g)+2I2(g)?4HI(g)的平衡常数K4为K12=492=2401
故答案为:$\frac{1}{49}$;7;2401;
点评 本题考查化学平衡的计算,明确平衡常数的计算方法及平衡常数与反应方程式的关系,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 不同的原子之间只能构成共价化合物 | |
| B. | 单质中不一定存在非极性键 | |
| C. | 非金属原子之间只能构成共价化合物 | |
| D. | Cl2的沸点比F2高,这与化学建的大小有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
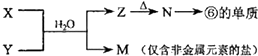 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| W | |||||||
| X | Y | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI>HCl>NH3 | B. | HCl>NH3>HI | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com