
����Ŀ�������a��pʮһ��Ԫ�������ڱ��е�λ�ã���ش��������⣺
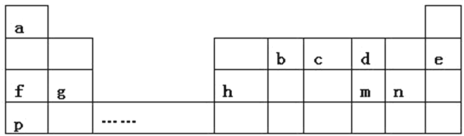
��1��m�������ӽṹʾ��ͼΪ________
��2��dԪ�������ڱ��е�λ��Ϊ________
��3��b�����������ĽṹʽΪ________
��4��d��g��n�γɵļ����ӵİ뾶�ɴ�С��˳��Ϊ________�������ӷ�����д����
��5��f��g��p������������ˮ������Դ�ǿ������˳��Ϊ________���ѧʽ����
��6��p��n����Ԫ������������ˮ�������Ӧ�Ļ�ѧ��Ӧ����ʽΪ________
��7��c���⻯���c������������Ӧˮ����֮�䷴Ӧ�Ļ�ѧ����ʽΪ________
��8������Ԫ����ɵ����������п�ͼ�е�ת����ϵ�����м�Ϊ10��������
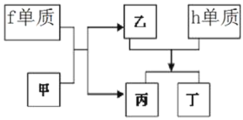
�ٶ�����________��ѡ�������ӻ��������������ۻ�����������
����д��h�������ҷ�Ӧ�����ӷ���ʽ________
���𰸡�![]() �ڶ����ڵ�VIA�� O=C=O Cl����O2����Mg2+ KOH��NaOH��Mg(OH)2 KOH+HClO4KClO4+H2O NH3+HNO3NH4NO3 ���ӻ����� 2Al+2OH��+2H2O2AlO2��+3H2��
�ڶ����ڵ�VIA�� O=C=O Cl����O2����Mg2+ KOH��NaOH��Mg(OH)2 KOH+HClO4KClO4+H2O NH3+HNO3NH4NO3 ���ӻ����� 2Al+2OH��+2H2O2AlO2��+3H2��
��������
��Ԫ�������ڱ��е�λ�ÿ�֪��aΪH��bΪC��cΪN��dΪO��eΪNe��fΪNa��gΪMg��hΪAl��mΪS��nΪCl��pΪK���ݴ˽��
��1��mΪS��������Ϊ16��������Ϊ��ԭ�ӵõ�2�����ӣ����������Ϊ18���ṹʾ��ͼΪ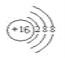 ����Ϊ
����Ϊ![]() ��
��
��2��dΪO����ԭ����8��Ԫ�أ�����������Ϊ8��������2�����Ӳ㣬��һ��2�����ӣ��ڶ���6�����ӣ������ڱ��е�λ��Ϊ�ڶ����ڵ�VIA�壻��Ϊ�ڶ����ڵ�VIA�塣
��3��bΪC�����������Ϊ������̼��CO2�ǹ��ۻ����̼ԭ�Ӻ���ԭ��֮����2�Թ��õ��Ӷԣ������ʽΪ![]() ���ṹʽΪO=C=O����ΪO=C=O��
���ṹʽΪO=C=O����ΪO=C=O��
��4��dΪOԪ�أ�gΪMgԪ�أ�nΪClԪ�أ�������ͬ�����Ų������ӣ�ԭ������������Ӱ뾶С����O��Mg�γɵļ����Ӿ�����ͬ�����Ų������ǵİ뾶��СΪO2-��Mg2+�����Ӳ���Խ�࣬�뾶Խ��Cl-��O2-������Cl-��O2-��Mg2+����ΪCl-��O2-��Mg2+��
��5��fΪNaԪ�أ�gΪMgԪ�أ�pΪKԪ�أ�Na��Mg����ͬ����Ԫ�أ��������ң������Լ�����������Na��Mg��Na��K����ͬ����Ԫ�أ��������£���������ǿ��������K��Na�����Խ�����K��Na��Mg��������Խǿ������������ˮ�������Խǿ��������������ˮ�������ΪKOH��NaOH��Mg(OH)2����ΪKOH��NaOH��Mg(OH)2��
��6��pΪKԪ�أ�����������ˮ����ΪKOH��nΪClԪ�أ�����������ˮ����ΪHClO4�����߷�Ӧ�Ļ�ѧ��Ӧ����ʽΪKOH+HClO4KClO4+H2O����ΪKOH+HClO4KClO4+H2O��
��7��cΪNԪ�أ������⻯��ΪNH3����������������Ӧˮ����ΪHNO3�����߷�Ӧ�Ļ�ѧ����ʽΪNH3+HNO3NH4NO3����ΪNH3+HNO3NH4NO3��
��8����ת����ϵ��֪fΪNa����Ϊ10��������������Na��Ӧ�����ΪH2O����ΪNaOH��hΪAl��Al��NaOH��Ӧ���ɱ�����֪��H2����ΪNaAlO2��
�ٶ�ΪNaAlO2�������Ӽ���Ϊ���ӻ������Ϊ���ӻ����
��Al��NaOH��Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O2AlO2��+3H2������Ϊ2Al+2OH��+2H2O2AlO2��+3H2����


 �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���KCl��BaCl2���ֹ�������Իش��������⣺
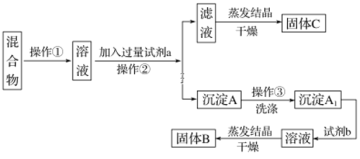
��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
(1)��������������______����������������_________��
(2)�Լ�a��________(�ѧʽ����ͬ)���Լ�b��_______������B��________��
(3)�����Լ�a��������Ӧ�Ļ�ѧ����ʽΪ_______�������Լ�b��������Ӧ�����ӷ���ʽΪ______��
(4)�÷����ܷ�ﵽʵ��Ŀ�ģ�_____(������������������)�������ܣ�Ӧ��θĽ���(���ܣ����ʲ��ûش�)___��
(5)��Ҫ�ⶨԭ�������BaCl2����������������Ҫȷ���������������⣬���ٻ�Ҫ��õ�������____��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��Ӧ�ﵽƽ�⣬ƽ�ⳣ��K=![]() ������ʱ���¶����ߣ�H2Ũ�ȼ�С������˵����ȷ���ǣ� ��
������ʱ���¶����ߣ�H2Ũ�ȼ�С������˵����ȷ���ǣ� ��
A. �÷�Ӧ���ʱ�Ϊ��ֵ
B. �����£�����ѹǿ��H2Ũ��һ����С
C. �����¶ȣ��淴Ӧ���ʼ�С
D. �÷�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�SO2�����ʵ�̽��ʵ�鱨���¼��ʵ��������ȷ����
ʵ�� |
| ||||
��¼ | A | ��ɫ | ��ɫ | ��ɫ��Һ | ��ɫ��Һ |
B | ��ɫ | ��ɫ | ��ɫ���� | ��ɫ���� | |
C | ��ɫ | ��ɫ | ��ɫ���� | ��ɫ��Һ | |
D | ��ɫ | ��ɫ | ��ɫ��Һ | ��ɫ��Һ | |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
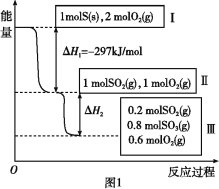
����Ŀ�����º���������,����Է�������ת��,�䷴Ӧ���̺�������ϵ��ͼ1��ʾ��
��֪��2SO2(g)+O2(g)![]() 2SO3(g) ��H=-196.6 kJ/mol��
2SO3(g) ��H=-196.6 kJ/mol��
��ش��������⣺
��1��д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��2��״̬II��״̬III�ų�������Ϊ ��
��3�����º���ʱ,1 mol SO2��2 mol O2��ַ�Ӧ,�ų���������ֵ���O��H2�O (������������С�����������)��
��4�������еĻ������ͨ��������NaOH��Һ������NaOH�����ʵ���Ϊ ������Һ�з�����������ԭ��Ӧ,��ù��̵����ӷ���ʽΪ�� ��
��5������������,���д�ʩ����ʹn(SO3)/ n(SO2)������� ��
A�������¶�
B������He��
C���ٳ���1 mol SO2(g)��1 mol O2(g)
D��ʹ�ô���
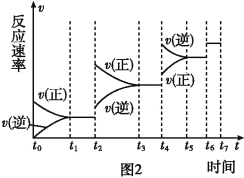
��6��ijSO2(g)��O2 (g)��ϵ��ʱ��t1�ﵽƽ��ı�ijһ�����������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ2��ʾ�������ı�SO2(g)��O2(g)��������ͼ��t4ʱ����ƽ���ƶ������������� ��ͼ�б�ʾƽ��������SO3�ĺ�����ߵ�һ��ʱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N2O��NO��Ӧ����N2��NO2�������仯��ͼ��ʾ������˵���������
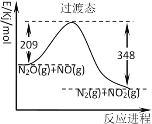
A.ʹ�ô������Խ�����̬������
B.��Ӧ������֮�ʹ�������������֮��
C.N2O(g)+NO(g)��N2(g)+NO2(g)+139kJ
D.��Ӧ��ļ����ܺʹ���������ļ����ܺ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ�л���������̼�������ɳ���ȼ�շ���������ͼ�ǵ¹���ѧ�����ϣ�ⶨ�л�����ɵ�װ�ã�����ͭ����������750������ʹ�л�������������ȫ������ΪCO2��H2O���ú��й����������ƺ��Ȼ��Ƶ����չֱܷ�����CO2��H2O��
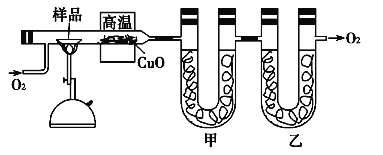
�Իش��������⣺
(1)��װ����ʢ�ŵ���___________��
(2)ʵ�鿪ʼʱ��Ҫ��ͨ������һ�����Ȼ���ټ��ȣ�Ϊʲô��_______________��
(3)��4.6 g �л���A����ʵ�飬�������5.4 g H2O��8.8 g CO2�����������C��H��Oԭ�Ӹ�������________��
(4)���ⶨ���л���A�ĺ˴Ź�������ʾ��ͼ��ͼ��ʾ����A�Ľṹ��ʽΪ____��
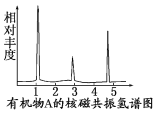
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ�úͲ������ܴﵽʵ��Ŀ�ĵ��ǣ� ��
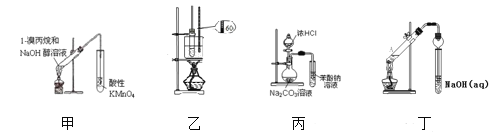
A. װ�ü����ڼ���1����������ȥ����B. װ��������ʵ������������
C. װ�ñ���֤�����ԣ����̼�����D. װ�ö�������ȡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T������������������������ȡ������жϲ���ȷ����(���� )
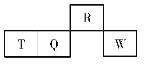
A.����������Ӧˮ��������ԣ�Q��W
B.�����̬�⻯������ȶ��ԣ�R��Q
C.ԭ�Ӱ뾶��T��Q��R
D.��T�����У�TԪ��ֻ�ܴ�������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com