
【题目】化学是研究物质的组成,结构,性质以及变化规律的一门以实验为基础的学科,在给定条件下,下列物质间转化均能实现的一组是( )
(1)![]()
(2)![]()
(3)![]()
(4)![]()
A.(1)(2)B.(2)(3)C.(2)(4)D.(3)(4)
科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是( )

①在外电路中,电流由铜电极流向银电极;
②正极反应为Ag++e-=Ag;
③实验过程中取出盐桥,原电池仍继续工作;
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同;
A.①②B.③④C.②④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列问题:
(1)相对分子质量为72且沸点最低的烷烃的习惯名称是______。
(2)用系统命名法命名 ______
______
(3)某烯烃分子式为![]() ,其同分异构体中主链为4个碳原子的有_______种。
,其同分异构体中主链为4个碳原子的有_______种。
(4)合成高聚物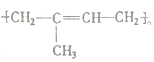 其单体的键线式______。
其单体的键线式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.将金属钠投入水中: Na+2H2O= Na+ +2OH-+H2↑
B.向AlCl3溶液中加入过量氨水: Al3+ +4NH3·H2O = AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.向水中通入NO2: 2NO2+H2O= 2H++ NO![]() +NO
+NO
D.向Na2SiO3溶液中滴加稀盐酸: SiO![]() +2H+ = H2SiO3↓
+2H+ = H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 碳与适量水蒸气反应生成CO和H2,需吸收
碳与适量水蒸气反应生成CO和H2,需吸收![]() 热量,此反应的热化学方程式为_________________
热量,此反应的热化学方程式为_________________
(2)已知![]() ;
;![]()
![]() ;
;![]()
![]() ;
;![]()
常温下,取体积比4:1的甲烷和氢气的混合气体![]() (标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是( )
A.将镁条点燃后迅速伸入集满![]() 的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生
的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生
B.向盛有![]() 溶液的试管中加过量铁粉,充分振荡后加1滴
溶液的试管中加过量铁粉,充分振荡后加1滴![]() 溶液,黄色逐渐消失,再加
溶液,黄色逐渐消失,再加![]() 后溶液颜色不变
后溶液颜色不变
C.将![]() 溶液加入
溶液加入![]() 溶液中,有白色沉淀生成,
溶液中,有白色沉淀生成,![]() 结合
结合![]() 的能力强于
的能力强于![]()
D.制取较高浓度的次氯酸溶液,将![]() 通入碳酸钠溶液中
通入碳酸钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,某同学为确认其成分,设计并完成了如下实验。由此可知原溶液中,下列有关说法正确的是( )
,某同学为确认其成分,设计并完成了如下实验。由此可知原溶液中,下列有关说法正确的是( )
(![]() )
)
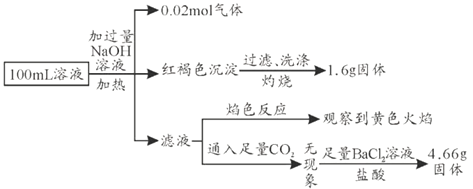
A.原溶液中![]()
B.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 、
、![]() 一定不存在
一定不存在
C.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
D.要确定原溶液中是否含有![]() ,其操作如下:取少量原溶液于试管中,滴加
,其操作如下:取少量原溶液于试管中,滴加![]() 溶液,紫红色不消失
溶液,紫红色不消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.![]() 可表示单核10电子粒子基态时的电子排布
可表示单核10电子粒子基态时的电子排布
B.电子仅在激发态跃迁到基态时才会产生原子光谱
C.同一原子能层越高,s电子云的半径越大
D.N、O、F电负性逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
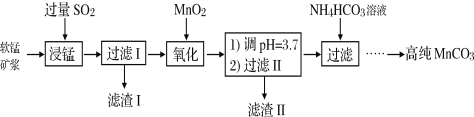
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O
ⅱ:____________________________________________(离子方程式)。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____________(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
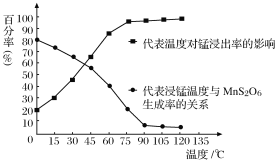
(4) “浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5).加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______________________________________________________。
Ⅱ.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应式Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
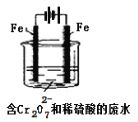
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com