
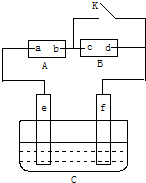
 如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:分析 ①由B上的c点显红色判断c的电极,根据c的电极判断a、b的电极;
②根据溶液中离子的放电顺序判断生成物,由反应物、生成物写出相应的方程式.
③先判断e、f的电极,再根据阴阳极上发生的反应写出相应的电极反应式;根据电镀原理选取电解质;
(4)①反应前,n(Ag+)=0.018 mol•L-1×0.05 L=0.9×10-3 mol,n(Cl-)=0.020 mol•L-1×0.05 L=1×10-3 mol;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol•L-1,c(Ag+)依据Ksp(AgCl)计算得到,溶液PH=-lgc(H+);
②再计算混合后溶液,不发生反应时c(Ag+)、c(Cl-),计算离子浓度积,与溶度积比较,判断是否产生沉淀.
解答 解:①B外接电源,所以B是电解氯化钠溶液的电解池;B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上氢离子得电子放电,所以c是阴极,外电源b是负极,a是正极.
故答案为:正;
②电解氯化钠溶液时,溶液中的离子放电顺序为:氢离子放电能力大于钠离子,氯离子放电能力大于氢氧根离子,所以电解氯化钠时生成物是氯气、氢气、氢氧化钠,所以其反应方程式为 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
③电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极上电极反应式为Zn-2e-=Zn2+;阴极上的电极反应式为Zn2++2e-=Zn;电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnSO4、Zn(NO3)2溶液作电镀液.
故答案为:Zn-2e-=Zn2+;Zn2++2e-=Zn;ZnSO4、Zn(NO3)2;
(4)①反应前,n(Ag+)=0.018 mol•L-1×0.05 L=0.9×10-3 mol,n(Cl-)=0.020 mol•L-1×0.05 L=1×10-3 mol;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol•L-1,c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7 mol•L-1,H+没有参与反应,完全沉淀后,c(H+)=0.010 mol•L-1,pH=2,故
故答案为:1.0×10-7 mol•L-1;2;
②再向反应后的溶液中加入50mL0.001mol•L-1盐酸,不发生反应时c(Ag+)=$\frac{2}{3}$×1.8×10-7mol•L-1=1.2×10-7mol•L-1、c(Cl-)=$\frac{2}{3}$×[(0.001+1.8×10-7+0.001]mol•L-1≈0.001mol•L-1,而离子浓度积=0.001×1.2×10-7=1.2×10-10<1.8×10-10,故没有沉淀产生,
故答案为:无.
点评 本题考查了盐类水解的分析判断,溶液酸碱性和PH大小比较,溶度积常数计算应用,掌握基础是关键,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: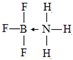 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料,有着重要的用途和应用前景.
甲醇是一种重要的化工原料,有着重要的用途和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
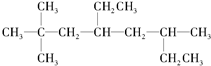 用系统命名法命名烃A2,2,6-三甲基-4-乙基辛烷;烃A的一氯代物具有不同沸点的产物有10种,若烃A由单烯烃与H2加成所得,则原单烯烃有8种结构.
用系统命名法命名烃A2,2,6-三甲基-4-乙基辛烷;烃A的一氯代物具有不同沸点的产物有10种,若烃A由单烯烃与H2加成所得,则原单烯烃有8种结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | H2O | C. | NH4Cl(固体) | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


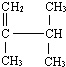 2,3-二甲基-1-丁烯(用系统命名法命名)
2,3-二甲基-1-丁烯(用系统命名法命名)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com