
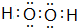 ,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程
,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程 .
.分析 A、B、C、D、E、F为短周期元素且原子序数依次增大,A的核外电子数与周期数相等,则A为H元素;D的次外层电子数为最外层的三分之一,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数都小于氧,故X为碳酸的铵盐,可能为正盐碳酸铵或酸式盐碳酸氢铵,则B为碳元素、C为N元素;E原子半径在同周期中除稀有气体外最大,处于IA族,原子序数大于氧,则E为Na;E与F可形成离子化合物EF,故F为Cl元素;G的合金在生活中用量最大,用途最广,该合金为钢,则G为Fe元素,据此进行解答.
解答 解:A、B、C、D、E、F为短周期元素且原子序数依次增大,A的核外电子数与周期数相等,则A为H元素;D的次外层电子数为最外层的三分之一,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数都小于氧,故X为碳酸的铵盐,可能为正盐碳酸铵或酸式盐碳酸氢铵,则B为碳元素、C为N元素;E原子半径在同周期中除稀有气体外最大,处于IA族,原子序数大于氧,则E为Na;E与F可形成离子化合物EF,故F为Cl元素;G的合金在生活中用量最大,用途最广,该合金为钢,则G为Fe元素.
(1)G为Fe,在元素周期表中的位置是:第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故D、E、F离子半径由大到小顺序为:Cl->O2->Na+,
故答案为:Cl->O2->Na+;
(3)A与D可形成原子个数比为1:1的化合物为H2O2,电子式为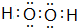 ,B的最高价氧化物为CO2,结构式为O=C=O,用电子式表示NaCl的形成过程:
,B的最高价氧化物为CO2,结构式为O=C=O,用电子式表示NaCl的形成过程: ,
,
故答案为: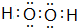 ;O=C=O;
;O=C=O; ;
;
(4)D与E形成某离子化合物具有漂白性,该化合物为Na2O2,过氧化钠与B与D形成的化合物二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(5)X为正盐,则X为碳酸铵,碳酸铵加热分解生成氨气、二氧化碳气体和水,反应的化学方程式为:(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O+CO2↑,该盐与氢氧化钠溶液共热的离子方程式:OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O+CO2↑; OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(6)B的简单氢化物为甲烷,甲烷、氧气与KOH作电解质溶液所构成的原电池,负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根与水,负极反应式为:CH4-8e-+10OH-=CO32-+7 H2O,
故答案为:CH4-8e-+10OH-=CO32-+7 H2O.
点评 本题考查位置结构与性质关系的综合应用,题目综合性强,推断各元素为解答关键,侧重对化学用语的考查,熟练掌握元素化合物性质,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g)放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g)的△H<0 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的球棍模型示意图为: | B. | 乙烯的实验式为:CH2 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | 2-乙基-1,3-丁二烯分子的键线式: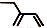 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素的金属性比第IIA族元素的金属性强 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA元素 | |
| C. | 碱金属的熔点和密度都是随着原子序数的增大而增大 | |
| D. | 如果发现了原子序数为117号元素,它应该属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 生活中常使用热的纯碱溶液去除油污 | |
| C. | 明矾具有强氧化性,常用于自来水的杀菌消毒 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com