
A.加入适量的水 B.加入适量的NaOH固体
C.加入适量的SO2 D.加入适量的CuSO4固体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省濉溪县高三第四次月考化学试卷(解析版) 题型:实验题
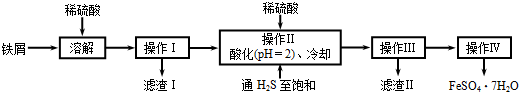
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。

(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是 。
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
(3)操作IV的顺序依次为: 、冷却结晶、 。
(4)测定绿矾产品中Fe2+ 含量的方法是:
a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol∙L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①已知KMnO4酸性溶液与Fe2+ 反应时被还原为Mn2+,请写出该反应的离子方程式: ;
②计算上述样品中FeSO4∙7H2O的质量分数为 (用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省高三上学期期中考试理综化学试(解析版) 题型:实验题
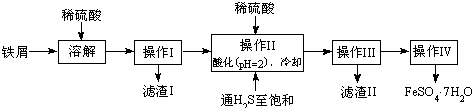
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)操作II中,通入硫化氢至饱和的目的是 _________________________ ;在溶液中用硫酸酸化至pH=2的目的是 _______________________________ 。
(2)检验制得的绿矾晶体中是否含有Fe3+的实验操作是 。
(3)测定绿矾产品中Fe2+含量的方法是:
a.称取3.7200g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①已知KMnO4酸性溶液与Fe2+反应时被还原为Mn2+,请写出该反应的离 ;
②在滴定实验中不能选择 式滴定管,理由是 ;
③计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留两位小数)。
查看答案和解析>>
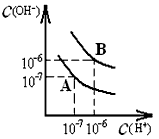
科目:高中化学 来源:0101 期中题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com