
| A. | 将称量NaOH固体时在烧杯中溶解后立即转移到容量瓶中 | |
| B. | 向容量瓶中加水定容时俯视 所配溶液浓度偏高 | |
| C. | 配制NaOH溶液不需用到量筒 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
分析 A.溶解后需要冷却至室温;
B.加水定容时俯视,V偏小;
C.浓溶液配制稀溶液时,需要量筒;
D.定容后摇匀,发现液面降低,为正常现象.
解答 解:A.溶解后需要冷却至室温,然后再转移到容量瓶中,故A错误;
B.加水定容时俯视,V偏小,由c=$\frac{n}{V}$可知,浓度偏高,故B正确;
C.浓溶液配制稀溶液时,需要量筒量取浓溶液的体积,故C错误;
D.定容后摇匀,发现液面降低,为正常现象,不需要补加少量水,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液的配制、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | x=4 | |
| B. | 平衡时气体压强是原来压强的1.1倍 | |
| C. | A的平衡浓度是1.4 mol•L-1 | |
| D. | B的转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示反应的速率为0.1 mol•L-1•s-1 | |
| B. | 用B表示反应速率为0.4 mol•L-1•s-1 | |
| C. | 3s时生成C的物质的量为1.2mol | |
| D. | 3s时B的浓度为0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
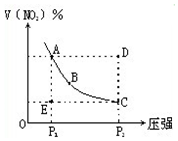 对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )
对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )| A. | A、C两点的正反应速率的关系A>C | |
| B. | A、B、C、D、E各状态,V正>V逆的是状态D | |
| C. | 使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从P1突然加压至P2 | |
| D. | 维持P1不变,E→A所需时间为x,维持P2不变,D→C所需时间为y,则x<y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液和NaOH溶液 | B. | NaOH溶液和CO2 | ||
| C. | Na和O2 | D. | Na2CO3溶液和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g O2中电子数为4NA | |
| B. | 3.4gNH3中含原子总数为0.6 NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量约为28g | |
| D. | 标况下,33.6 L的四氯化碳中,四氯化碳分子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
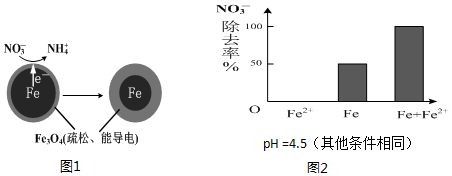 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 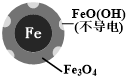 | 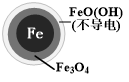 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.014 mol | B. | 0.01 mol | C. | 0.007 mol | D. | 0.005 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com