
| A.热稳定性:HF>HCl>HBr>HI |
| B.微粒半径:K+>Na+>Mg2+>Al3+ |
| C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D.第一电离能:Na<Mg<Al<Si |
科目:高中化学 来源:不详 题型:填空题
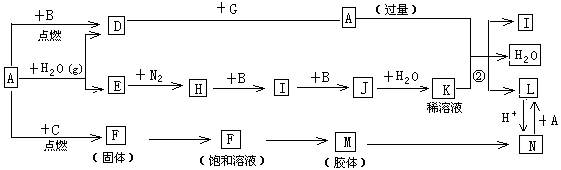
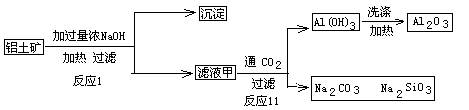
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:HClO4>HNO3>H3PO4>H2SiO3 |
| B.稳定性:H2S>HCl>HBr>HI |
| C.熔点:Rb>K>Na>Li |
| D.熔、沸点:HI>HBr >HCl>HF |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.位于第四周期第VIA族 |
| B.碘-131的摩尔质量为131g |
| C.碘的原子核内有131个质子 |
| D.碘-131原子中中子数与核外电子数之差为25 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
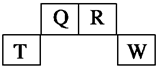
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: 。
。| A.原子半径:a>c>d | B.相应氢化物的沸点:d>c>a |
| C.非金属性:c>a>d | D.c与a、c与b均能形成两种常见化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、K+、Al3+、Ag+、Ba2+和Cl-、Br-、
、K+、Al3+、Ag+、Ba2+和Cl-、Br-、 、
、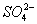 、
、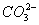 中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。
中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com