
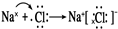
分析 短周期元素A、B、C、D原子序数依次增大,B的最外层电子数是次外层的3倍,最外层电子数不超过8个,则次外层为K层,则B为O元素;B、C的最外层电子数之和与D的最外层电子数相等,B的最外层电子数为6,D为短周期元素,如果D是Cl元素,则C是Na元素,A、C是同一主族,则A是H元素;如果D是Ar元素,则C是Mg原子,A、C是同一主族,A为Be元素,不符合只有C是金属元素条件,故舍去;所以A、B、C、D分别是H、O、Na、Cl元素,由此分析解答.
解答 解:短周期元素A、B、C、D原子序数依次增大,B的最外层电子数是次外层的3倍,最外层电子数不超过8个,则次外层为K层,则B为O元素;B、C的最外层电子数之和与D的最外层电子数相等,B的最外层电子数为6,D为短周期元素,如果D是Cl元素,则C是Na元素,A、C是同一主族,则A是H元素;如果D是Ar元素,则C是Mg原子,A、C是同一主族,A为Be元素,不符合只有C是金属元素条件,故舍去;所以A、B、C、D分别是H、O、Na、Cl元素,
(1)D为Cl元素,在周期表中处于第三周期ⅦA族,实验室制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:第三周期ⅦA族;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)A、B、C形成的化合物是氢氧化钠所含化学键类型是共价键;离子键,故答案为:共价键;离子键;
(3)钠与氯形成离子化合物,形成过程表示为: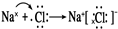 ,故答案为:
,故答案为: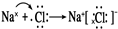 ;
;
(4)由元素B和D形成的单质或化合物能用于自来水消毒的是O3、Cl2、ClO2等,故答案为:O3、Cl2、ClO2中的两种.
点评 本题考查结构性质与位置关系,推断元素是解题关键,以B元素为突破口,综合分析原子序数、最外层电子数关系进行推断,侧重对化学用语的考查,难度中等.


科目:高中化学 来源: 题型:解答题
 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
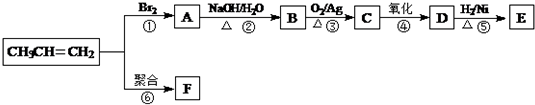
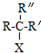 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$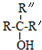 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)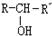 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$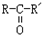 ,
,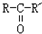 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$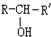
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | B与混合气体的体积比 | 反应后气体密度(已换算为标准状况;g/L) |
| 第一次 | 1.0 | 1.35 |
| 第二次 | 1.2 | 1.25 |
| 第三次 | 2.0 | 1.04 |
| 第四次 | 2.2 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com