
| A. | 从反应开始到达到平衡,所需时间tM>tN | |
| B. | 平衡时cM(I2)=c N(I2) | |
| C. | 平衡时I2 蒸气在混合气体中的体积分数:M>N | |
| D. | HI的平衡分解率αM=αN |
分析 容器M中HI的浓度大于容器B,则M中开始反应速率快,由于M容器中浓度大,故M的压强比N中大,M等效为N平衡的基础上增大压强,由于反应前后气体条件不变,增大压强平衡不移动,则HI的转化率不变,相同物质的含量相同,以此解答该题.
解答 解:A.M中浓度较大,则反应速率较大,达到平衡时间较小,故A错误;
B.两容器中平衡时HI的转化率相同,则平衡时cM(I2)>c N(I2),故B错误;
C.容器M、N中平衡为等效平衡,平衡时I2蒸气在混合气体中的体积分数相等,故C错误;
D.压强对平衡移动无影响,浓度不同,但平衡状态相同,则HI分解率相同,故D正确.
故选D.
点评 本题考查化学平衡计算与影响因素,为高频考点,侧重于学生的分析能力的考查,题目涉及等效平衡问题,较好的考查学生解决问题能力,难度中等.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:实验题
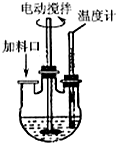 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
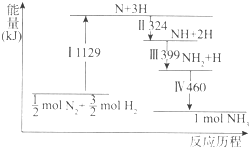
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | ||
| C. | Ⅳ中NH2与H2生成NH3 | D. | N2(g)+3H2(g)?2NH3(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时并不能将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池放电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | Na2CO3固体 | C. | NaCl晶体 | D. | CH3COONa固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com