
【题目】有8种物质:①新戊烷 ②甲苯 ③聚乙烯 ④![]() ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能和酸性高锰酸钾溶液反应又能与溴水反应的是
⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能和酸性高锰酸钾溶液反应又能与溴水反应的是
A.④⑤⑦⑧B.④⑦⑧C.④⑤⑧D.③④⑤⑦⑧
科目:高中化学 来源: 题型:
【题目】砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:________________________。
步骤①:消耗反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
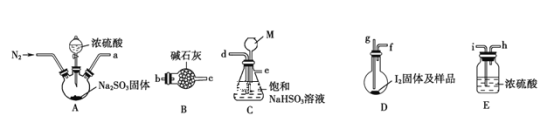
(2)装置连接的顺序为a__________(填接口字母顺序);M仪器的名称为__________,其在实验过程中的作用是__________________________。
(3)操作步骤①:连接装置并检查装置气密性,装入药品,_________________;关闭弹簧夹,打开分液漏斗活塞;反应结束后,关闭分液漏斗活塞,继续通入N2,取下D装置;步骤②:测定剩余的碘时,向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
(4)Na2S2O3标准液应装在________(填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________________。
(5)滴定实验重复四次得到数据如下:
实验 | 1 | 2 | 3 | 4 |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00g土壤样品和10.16gI2(已知I2过量),则样品土壤中水的含量为________%(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)![]() 中含有离子键,
中含有离子键,![]() 不溶于有机溶剂而
不溶于有机溶剂而![]() 、
、![]() 、
、![]() 能够溶于乙醇、乙醚等有机溶剂,原因是__________。
能够溶于乙醇、乙醚等有机溶剂,原因是__________。
(2)《中华本草》等中医典籍中,记载了炉甘石(![]() )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。![]() 中,阴离子空间构型为__________,
中,阴离子空间构型为__________,![]() 原子的杂化形式为__________。
原子的杂化形式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___;该反应在条件下能自发进行___(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
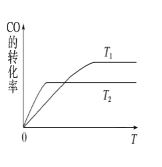
①T1___T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
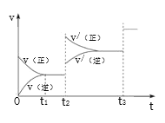
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___;t3时采取的措施可能是___。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度、相同浓度下的6种盐溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为

A.AlCl3 Al2(SO4)3 NaClOB.Al2(SO4)3 AlCl3 NaClO
C.Al2(SO4)3 AlCl3 NaOHD.CH3COOH AlCl3 Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,因而具有广泛应用前景。实验室制备CrN 反应原理为 CrCl3 +NH3![]() CrN+3HCl,装置如图所示
CrN+3HCl,装置如图所示

下列说法错误的是
A.装置①还可以用于制取O2、Cl2、CO2等气体
B.装置②、④中分别盛装NaOH溶液、KOH固体
C.装置③中也可盛装维生素c,其作用是除去氧气
D.装置⑤ 中产生的尾气冷却后用水吸收得到纯盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是
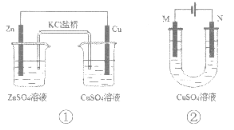
A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学通过查阅资料获得两个信息:一是在CaO存在的条件下,干燥的NaOH与干燥的CH3COONa混合加热可得到CH4;二是在加热条件下CH4可还原CuO。他们设计如下装置(加热仪器省略)制备CH4、还原CuO并验证B中有CO2、H2O生成。
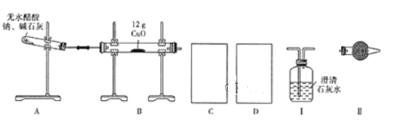
(1)为实现上述实验目的,C、D中的仪器应分别为_______________(填"Ⅰ、Ⅱ"或"Ⅱ、Ⅰ"),Ⅱ中的试剂是________________。
(2)A、B处均需要加热,实验中应先加热______处,表明B中有CO2生成的现象是_________。A中另一种生成物是常见的无机盐,A中反应的化学方程式为_________。
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:________________。
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是________,在常用的酸中,稀硫酸能不能换成稀硝酸_________(填“能”或“不能"),原因是_________。
②称量所得红色固体的质量,当固体质量(m)介于___________之间表明红色固体是Cu与Cu2O的混合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、碳、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式___。
(2)实验室用KSCN溶液、检验Fe3+。C、N、O的电负性由大到小的顺序为___(用元素符号表示),一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式___。
(3)FeCl3的熔点为306℃,沸点为315℃FeCl3的晶体类型是__。FeSO4常作补铁剂,SO42-的立体构型是__。
(4)CH3OH分子中O原子的杂化方式为___,键角:H-C-H___H-O-C。(填“<”、“>”、“=”)CH3OH能与H2O以任意比互溶的原因是___。
(5)已知C60分子结构和C60晶胞示意图(如图I、图Ⅱ所示):
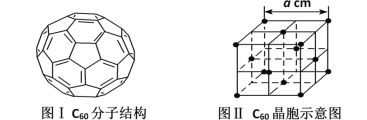
则一个C60分子中含有σ键的个数为__,与每个C60分子距离最近且相等的C60分子有__个,C60晶体的密度的表达式为__g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com